N-HEPTANE
n-Heptane آلکان با زنجیره مستقیم با فرمول شیمیایی H3C (CH2) 5CH3 یا C7H16 است. هنگامی که به عنوان یک جزء سوخت تست در موتورهای تست ضد ضربه استفاده می شود ، یک سوخت هپتان 100٪ نقطه صفر مقیاس رتبه بندی اکتان است (100 امتیاز 100٪ ایزو اکتان 100٪ است). عدد اکتان برابر با خصوصیات ضد ضربه در مخلوط مقایسه ای از هپتان و ایزوکتان است که به عنوان درصد ایزوoctane در هپتان بیان شده و در پمپ های بنزین توزیع شده در ایالات متحده و بین المللی ذکر شده است.
نام ماده: هپتان
نام تجارت: هپتان
EC شماره: 927-510-4
شماره CAS: 64742-49-0
کد HS: 27101225
کد محصول KH: 100116
فرمول: C7H16
مترادف: آلکان C7 / ASTM نرمال تست ضربه زدن به هپتان نرمال / دی پروپیل متان / دی پروپیل متان (= نرمال-هپتان) / ESSO هپتان / gettysolve-C / heptane ، بی آب / هپتانز / هپیل هیدرید / هگزیل متان / هیدروپتان هیدرید n-heptane / n-heptyl / normal-dipropylmethane / normal-heptane / normal-heptyl هیدیل / NORPAR 7 / معرف تنظیم کننده پروتئین S1 / SBP 94/99 / skellysolve C / حلال هپتان)
سولفات مس چیست؟
برای
خرید مس سولفات به سایت بیسموت مراجعه کنید

سولفات مس یک ترکیب معدنی است که گوگرد را با مس ترکیب می کند. این می تواند باکتری ها ، جلبک ها ، ریشه ها ، گیاهان ، حون ها و قارچ ها را از بین ببرد. سمیت سولفات مس بستگی به میزان مس دارد. مس یک ماده معدنی اساسی است. این ماده در محیط ، غذاها و آب یافت می شود. سولفات مس از سال 1956 برای استفاده در محصولات سموم دفع آفات در ایالات متحده به ثبت رسیده است.
برخی از محصولات حاوی سولفات مس چیست؟
محصولاتی که حاوی سولفات مس هستند می توانند مایعات ، غبارها یا کریستالها باشند. ده ها محصول فعال حاوی سولفات مس در ایالات متحده آمریکا وجود دارد. برخی از این موارد برای استفاده در کشاورزی ارگانیک تصویب شده است.
برای
قیمت سولفات مس به
سایت خرید و فروش مواد شیمیایی مراجعه کنید
همیشه دستورالعمل های برچسب را دنبال کنید و برای جلوگیری از قرار گرفتن در معرض اقداماتی انجام دهید. در صورت بروز هرگونه مواجهه ، حتماً دستورالعمل های First Aid را در برچسب محصول با دقت دنبال کنید. برای مشاوره درمانی بیشتر با مرکز کنترل سم با شماره 1-800-222-1222 تماس بگیرید. اگر می خواهید در مورد یک مشکل آفت کش صحبت کنید ، با شماره 1-800-858-7378 تماس بگیرید.
سولفات مس چگونه کار می کند؟
مس موجود در سولفات مس به پروتئین های قارچ ها و جلبک ها متصل می شود. این به سلولها آسیب می زند و باعث نشت و مرگ آنها می شود. در حونها ، مس عملکرد طبیعی سلول های پوست و آنزیم ها را مختل می کند.
برای
قیمت سولفات مس 5 آبه نیز میتوانید به بیسموت مراجعه کنید :)))))
چگونه ممکن است در معرض سولفات مس قرار بگیرم؟
اگر در حال استفاده از سولفات مس هستید و می توانید آن را روی پوست خود قرار دهید ، در معرض تنفس قرار بگیرید یا به طور اتفاقی محصولی را بخورید یا بنوشید ، می توانید در معرض دید قرار بگیرید. این امر همچنین می تواند رخ دهد اگر مقداری روی دست خود بیایید و بدون اینکه ابتدا دست خود را بشویید ، بخورید یا سیگار بزنید. با رعایت دقیق تمام دستورالعمل های برچسب ، می توانید میزان قرار گرفتن در معرض خود را کاهش داده و خطر را کاهش دهید.
علائم و نشانه هایی از مواجهه مختصر با سولفات مس چیست؟

سولفات مس می تواند باعث تحریک شدید چشم شود. خوردن مقادیر زیادی سولفات مس می تواند منجر به حالت تهوع ، استفراغ و آسیب به بافت های بدن ، سلول های خونی ، کبد و کلیه ها شود. با قرار گرفتن در معرض شدید ، شوک و مرگ ممکن است رخ دهد.
سولفات مس به روش مشابهی روی حیوانات تأثیر می گذارد. علائم مسمومیت در حیوانات شامل عدم اشتها ، استفراغ ، کم آبی ، شوک و مرگ است. اسهال و استفراغ ممکن است رنگ سبز تا آبی داشته باشد. برگه اطلاعات مربوط به حیوانات خانگی و استفاده از سموم دفع آفات را مشاهده کنید.
چه اتفاقی می افتد سولفات مس هنگام ورود به بدن؟
مس یک عنصر اساسی است و برای حمایت از سلامت مناسب لازم است. بدن انسان محیط داخلی خود را برای حفظ تعادل مس تنظیم می کند. در صورت خوراکی یا استنشاق سولفات مس در بدن جذب می شود. سپس به سرعت وارد جریان خون می شود. هنگامی که در داخل ، مس در بدن حرکت می کند. سپس به پروتئین ها متصل می شود و وارد اندام های مختلف می شود.
مس اضافی دفع می شود و غالباً در بدن ذخیره نمی شود. مس را می توان در کبد جمع کرد اما در ترشحات معده ، استخوان ، مغز ، مو ، قلب ، روده ، کلیه ها ، ماهیچه ها ، ناخن ها ، پوست و طحال نیز وجود دارد. مس عمدتا در مدفوع دفع می شود. مقادیر کمی نیز در مو و ناخن ها از بین می رود. در یک مطالعه ، محققان دریافتند که نیمی از دوز زیاد مس از بدن از 13 تا 33 روز طول می کشد.
برای
قیمت سولفات مس کشاورزی و
سولفات مس از کجا بخریم و
فروش عمده سولفات مس به سایت بیسموت مرجع خرید مواد شیمیایی مراجعه کنید.
آیا سولفات مس احتمالاً در پیشرفت سرطان نقش دارد؟
اینکه سولفات مس باعث ایجاد سرطان در حیوانات شود ، نامشخص است. آژانس حفاظت از محیط زیست ایالات متحده (EPA) رتبه بندی سرطان سولفات مس را منتشر نکرده است. این امر به دلیل عدم وجود شواهد در ارتباط با نمک مس یا مس با رشد سرطان در حیواناتی است که می توانند به طور معمول مس را در بدن خود تنظیم کنند.
یک مطالعه به بررسی قرار گرفتن در معرض طولانی مدت مربوط به کار در برابر سولفات مس پرداخته است. آنها خطر ابتلا به سرطان کلیه را افزایش دادند. یک مطالعه دیگر نشان داد که کاهش مس می تواند رشد سرطان را مهار کند. مطالعات حیوانی نتایج متناقضی را ارائه داده است.
آیا کسی از اثر مواجهه طولانی مدت با سولفات مس اثر غیر سرطان را مطالعه کرده است؟
مطالعات در انسان در مورد اثرات طولانی مدت غیرسرطانی بر سولفات مس مشخص نشده است. با این حال ، بیماری ویلسون ممکن است بینش در مورد اثرات بالقوه سلامتی در طولانی مدت را فراهم کند. بیماری ویلسون نوعی اختلال ژنتیکی نادر است که در آن بدن بیش از حد مس را حفظ می کند. این عوارض شامل ناباروری ، میزان سقط بالاتر ، از دست دادن قاعدگی و عدم تعادل هورمونی در ن است. در مردان بیضه به درستی عمل نمی کند. قرار گرفتن در معرض سولفات مس باعث بیماری ویلسون نمی شود.
در یک مطالعه ، موشها قبل و در دوران بارداری از مقادیر زیادی سولفات مس تغذیه می کردند. برخی از موش های کودک در حین حاملگی فوت کردند یا به طور طبیعی رشد نکردند.
آیا کودکان نسبت به بزرگسالان نسبت به سولفات مس حساس هستند؟
ممکن است کودکان نسبت به بزرگسالان نسبت به سموم دفع آفات حساس باشند. با این حال ، در حال حاضر هیچ داده ای وجود ندارد که نتیجه بگیرد کودکان حساسیت خاصی به سولفات مس دارند.
چه اتفاقی برای سولفات مس در محیط می افتد؟
مس به طور طبیعی در محیط رخ می دهد. مس در خاک ممکن است از منابع طبیعی ، سموم دفع آفات یا منابع دیگر سرچشمه بگیرد. اینها ممکن است شامل معدن ، صنعت ، مواد معماری و وسایل نقلیه موتوری باشد. مس عمدتا در سطح خاک جمع می شود ، جایی که محکم به هم می چسبد و ادامه می یابد.
پلیس
هر
سولفات مس در آب بسیار محلول است و می تواند به رسوبات متصل شود. مس توسط گیاهان تنظیم می شود زیرا یک ماده معدنی اساسی است. مس بسیار زیاد می تواند برای گیاهان سمی باشد زیرا باعث مهار فتوسنتز می شود.
آیا
سولفات مس می تواند بر پرندگان ، ماهی یا سایر حیوانات وحشی تأثیر بگذارد؟
ایالات متحده آمریکا EPA مس را عملاً غیر سمی برای زنبورها و نسبتاً سمی برای پرندگان می داند. مطالعات انجام شده با چندین گونه آبزی دریافته است که مس بسیار از نظر ماهی و آبزیان بسیار سمی است. ماهی قزل آلا ، کوی و نوجوانان از چندین گونه به ویژه به مس حساس هستند.
کشتار ماهی پس از کاربرد سولفات مس برای کنترل جلبکها در استخرها و دریاچه ها گزارش شده است. کاهش اکسیژن و افزایش آوار به عنوان علت بیشتر مرگ ماهی ذکر شده است. این گاهی اوقات به دلیل مرگ ناگهانی و پوسیدگی جلبک ها و گیاهان بعد از استفاده از برنامه است. حتی غلظت اندک مس نیز می تواند برای ماهی ها و ارگانیسم های آب مضر باشد. همیشه از دستورالعمل های برچسب پیروی کنید تا از محیط زیست محافظت کنید.

هیدروکینون
کرم هیدروکینون عامل دفع زدا یا روشن کننده پوست است. از نظر بالینی از این روش برای درمان مناطقی از
شایع ترین کاربرد آن در بیماران مبتلا به هایپرپیگمانتاسیون بعد از التهاب و ملاسما است.
هایپرپیگمانتاسیون پس از التهاب ناشی از التهاب جلدی است و باعث افزایش تولید ملانین می شود. علل عمده فشار خون بالا بعد از التهاب عبارتند از: آکنه ولگاریس ، درماتوزهای اگزماتوز ، درماتیت تماسی ، پسوریازیس ، لیکن پلان و سوختگی. [1] شایع ترین علت افزایش فشار خون ناشی از عکس گرفتن از نور خورشید است. [2] التهاب باعث آزاد شدن و اکسیداسیون اسید آراشیدونیک به پروستاگلاندین ها و لکوترین ها می شود و در نتیجه باعث افزایش تولید ملانین می شود. [3] از هیدروکینون برای درمان هایپرپیگمانتاسیون بعد از التهاب به همراه عکس محافظت می شود. بهبود با هیدروکینون طی چند هفته تا چند ماه رخ می دهد. [4]
ملاسما یک وضعیت افزایش فشار خون اکتسابی است و در نواحی در معرض آفتاب صورت ، به طور معمول پیشانی ، گونه ها و چانه ارائه می شود. [5] این ماکول ها و تکه های رنگدانه توزیع شده متقارن را ارائه می دهد. [6] عواملی که در پاتوژنز ملاسما نقش دارند پوست تیره تر ، اشعه ماوراء بنفش ، هورمون ها ، ژنتیک و داروهای ضد صرع است. قرار گرفتن در معرض اشعه ماوراء بنفش عامل اصلی پاتوژنز است زیرا تابش اشعه ماوراء بنفش باعث افزایش سطح هورمون تحریک کننده آلفا-ملانوسیت و هورمون آدرنرژیک می شود که باعث افزایش تکثیر ملانوسیت ها می شود. [7] همچنین در لایه پوستی افزایش بیان سلولهای بنیادی فیبروبلاست و گیرنده تیروزین کیناز c-kit در ضایعات ملاسما خشمگین است. همچنین در ضایعات ذکر شده می توان به تنظیم فاکتور رشد اندوتلیال عروقی (VEGF) ، Wnt و گونه های اکسیژن واکنش پذیر که پس از التهاب پوستی ناشی از اشعه ماوراء بنفش دیده می شود اشاره کرد. عروق و بیش فعالی ملانوسیت ناشی از این التهاب ناشی از اشعه ماوراء بنفش منجر به افزایش تولید ملانین و افزایش فشار خون می شود. بیمارانی که باردار هستند یا از داروهای ضد بارداری خوراکی استفاده می کنند نیز در معرض خطر هستند زیرا بیان گیرنده های استروژن در ضایعات ملاسما نیز افزایش می یابد. [8] [6] استروژن همچنین باعث آزادسازی هورمون تحریک کننده ملانوسیت (MSH) می شود که تیروزیناز را تحریک می کند و منجر به افزایش تولید ملانین می شود. به همین دلیل ، ملاسما بیشتر در ن و مردان اتفاق می افتد [6]. درمان شبیه به هایپرپیگمانتاسیون بعد از التهاب است که خط اول از آن محافظت می شود و هیدروکینون.
محافظت در برابر نور مهمترین ویژگی در استفاده حداکثر از هیدروکینون است. ملانوسیتها از UVB ، UVA و حتی نور مرئی که منجر به رنگدانه می شود تحریک می شوند. بنابراین ، کرم های ضد آفتاب با طیف گسترده ای یک استراتژی پیشنهادی است. [6]
هیدروکینون به دلیل مشخصات ایمنی ناشناخته ، FDA مورد تأیید نیست. در اتحادیه اروپا ، استرالیا و ژاپن ممنوع است.
هیدروکینون با مهار سنتز ملانین به عنوان یک عامل depigmentation پوست عمل می کند. این ماده با مهار تیروزیناز به دلیل شباهت ساختاری آن با آنالوگ از پیش سازهای ملانین ، تبدیل L-3،4- دی هیدروکسی فنیل آلانین (L-DOPA) به ملانین را مهار می کند. [6]
هیدروکینون فقط به صورت موضعی به عنوان یک عامل دفع آب استفاده می شود. یک لایه نازک با نوک انگشتان اعمال می شود و به صورت (یا سایر مناطق آسیب دیده) 1 تا 2 بار در روز به مدت 3 تا 6 ماه مالیده می شود. اگر بعد از 2 تا 3 ماه نتیجه ای حاصل نشود ، باید هیدروکینون قطع شود. استفاده از هیدروکینون به طور یکنواخت بر روی کل صورت برای جلوگیری از رنگدانه ناهموار و استفاده همزمان از ضد آفتاب برای محافظت از آسیب در برابر اشعه ماوراء بنفش ، که باعث افزایش رنگدانه می شود ، ضروری است. پزشکان برای کاهش خطر عوارض جانبی توصیه کردند که پس از این مدت چند ماه قبل از شروع مجدد ، متوقف شوند. همچنین می تواند در طول تعطیلات آخر هفته فقط یا سه بار در هفته برای درمان طولانی تر نگهداری با حداقل عوارض استفاده شود. [6]
هیدروکینون در 2٪ از پیشخوان یا همانطور که 4٪ تجویز می شود در دسترس است. [2] این فرم به دوز زیر است: کرم ، امولسیون ، ژل ، یا محلول.
مطالعات متعدد نشان داده اند که حداکثر نتایج در هنگام استفاده از هیدروکینون به عنوان درمان ترکیبی با رتینوئید و کورتیکواستروئید اتفاق می افتد. پرکاربردترین کرم ترکیبی سه گانه از هیدروکینون 4٪ ، ترتئینین 0.05٪ و فلوکینولون استونید 0.01٪ تشکیل شده است. [6] استفاده در ترکیب با سایر عوامل نیاز به تجویز پزشک متخصص پوست دارد.
نتایج در بین هر بیمار متفاوت است.
حدود 35 تا 45 درصد هیدروکینون پس از موضعی جذب سیستماتیک می شود
استفاده کنید. [10]
عوارض جانبی [11] [6] [2]:
به ندرت ochronosis - ochronosis یک تغییر رنگ آبی-سیاه یا خاکستری-آبی است. در بیمارانی که از غلظت بالایی از هیدروکینون برای مدت طولانی در مناطق بزرگ بدن استفاده می کنند ، نادر است و بیشتر دیده می شود.
مطالعات همچنین حاکی از آن است که هیدروکینون می تواند گلوکز مویرگی را به طور غلط بالا ببرد که با یک گلوکومتر اندازه گیری شود. [12]
درمورد نگرانی ها مبنی بر اینکه کرم هیدروکینون سرطان زا یا در عمل بالینی یا تحقیقات انسانی است ، تائید نشده است. [6]
حدود 35 تا 45٪ از دوز موضعی هیدروکینون سیستماتیک جذب می شود. مطالعات فعلی افزایش خطر ناهنجاری یا عوارض جانبی در ن باردار را نشان نداده است ، اما توصیه می شود که به دلیل جذب قابل توجهی میزان قرار گرفتن در معرض را به حداقل برسانید. [10] ایمنی مادران شیرده و در کودکان هنوز تثبیت نشده است و به همین ترتیب ن شیرده باید از این دارو خودداری کنند.
نظارت بر هرگونه حساسیت یا تحریک طولانی مدت داشته باشید ، در این صورت دارو باید قطع شود. همچنین ، در موارد نادر ، اوکرونوز ایجاد می شود ، استفاده از هیدروکینون را متوقف کنید و با یک پزشک م کنید.
با استفاده موضعی از کرم هیدروکینون سمیت قابل توجهی پیدا نشده است.
برخی از مطالعات بدخیمی را در حیواناتی که برای مدت طولانی با دوزهای خوراکی بزرگ تحت درمان قرار گرفته اند ، گزارش می کنند. [2]
در محیط زیست ، هیدروکینون یک ماده شیمیایی است و می تواند با تنظیم تولید گونه های اکسیژن واکنشی ، استرس اکسیداتیو و از این رو پتانسیل آسیب به DNA در تنظیم فعالیت های انسانی و صنعتی سمی باشد. این یک متابولیت بنزن اصلی است و در این تنظیمات از نظر کبدی و سرطان زا شناخته می شود. برخی مطالعات حاکی از آن است که می تواند رشد سلول تومور را تقویت کرده و پاسخ ایمنی را سرکوب کند. در عکاسی استفاده می شود و در رنگها ، رنگها ، روغنهای لاک الکل و سوختهای موتور وجود دارد. در فرم اکسیده شده آن ، سمی تر بوده و کمتر تخریب می شود. این سمیت بالا به موجودات آبزی و جوندگان نشان می دهد و ممکن است لوسمی ، تومور سلولی کلیوی و سرطان کبد را القا کند. همچنین مشخص شده است که با افزایش پاسخهای سلولهای ایمنی در پاسخ سلولهای ایمنی تأثیر می گذارد و با افزایش تولید اینترلوکین 4 و ایمونوگلوبولین E باعث افزایش واکنش آلرژیک می شود.
تیم مراقبت های بهداشتی مانند پزشکان ، پرستاران و داروسازان نقش مهمی در نظارت بر بیماران بر روی هیدروکینون دارند. نظارت بر بیماران بسیار مهم است تا اطمینان حاصل شود که آنها فقط از داروهایی که در مدت تجویز بیشتر از 5 تا 6 ماه تجویز شده اند برای محدود کردن عوارض جانبی استفاده می کنند. پرسنل پرستاری می توانند نقش مهمی در نظارت بر بیمار داشته باشند و همچنین ارزیابی انطباق را انجام دهند ، زیرا پیروی از دستورالعمل های مربوط به برنامه های کاربردی دارو ، فراوانی آن ، باید مراقب هرگونه عارضه جانبی باشد که باید به روشنی برای بیمار توضیح داده شود . در صورت بروز هرگونه تحریک ، حساسیت و حساسیت یا واکنش آلرژیک باید به بیماران دستور داده شود که از مصرف دارو خودداری کنند. داروسازان می توانند هنگام استفاده از دارو و عوارض جانبی آن را هنگام استفاده از دارو بررسی کنند و از ورود بیمار برای پر کردن مجدد ، نظارت کنند و پزشک معالج را در مورد هرگونه نگرانی هشدار دهند. عارضه نادر و در عین حال به طور بالقوه مضر ، ممکن است برای بیمارانی که از هیدروکینون استفاده می کنند ، توضیح داده شود و در صورت بروز این بیماری باید به آنها دستور داده شود که بلافاصله این دارو را قطع کنند. یک رویکرد تیم مشترک بین حرفه ای در مورد هیدروکینون درمانی نتایج را به طور مؤثر راهنمایی می کند. [سطح V]
خرید هیدروکینون
1
اپستین جی. افزایش فشار خون پس از التهاب. کلینیک درماتول 1989 آوریل-جون ؛ 7 (2): 55-65. [PubMed]
2
Stephens TJ، Babcock M، Bucay V، Gotz V. ارزیابی تقسیم چهره ای از فوم روشن کننده چند ماده در مقابل کنترل مرجع در ن با پوست صورت فوتوداماژ شده. J Clin Aesthet Dermatol. اکتبر 2018 ؛ 11 (10): 24-28. [مقاله رایگان PMC] [PubMed]
3
Tomita Y، Maeda K، Tagami H. مکانیسم های افزایش فشار خون در رنگدانه های بعد از التهاب ، پیگمنتهای ادراری و آفتاب سوختگی. درماتولوژی 1989؛ 179 فر 1: 49-53. [PubMed]
4
Katsambas AD ، Stratigos AJ. مواد ضد عفونی کننده و سفید کننده: مقابله با فشار خون بالا. کلینیک درماتول 2001 ژوئل-آگوست ؛ 19 (4): 483-8. [PubMed]
5
Kauh YC ، Zachian TF. ملاسما پیشگویی هزینه مد بیول 1999 ؛ 455: 491-9. [PubMed]
6
Sofen B، Prado G، Emer J. Melasma و Hyperpigmentation Post Inflammatory: به روز رسانی مدیریت و نظر متخصصین. برگ درمانی پوست. 2016 ژانویه ؛ 21 (1): 1-7. [PubMed]
7
محمود BH ، روولو E ، هگزل CL ، لیو Y ، اوون MR ، Kollias N ، Lim HW ، Hamzavi IH. تأثیر اشعه ماوراء بنفش با طول موج طولانی و نور مرئی بر روی پوست ملانوس. سرمایه گذاری درماتول 2010 اوت ؛ 130 (8):
2092-7. [PubMed]
8
Lieberman R، Moy L. بیان گیرنده استروژن در ملاسما: نتیجه پوست صورت بیماران مبتلا. ج مواد مخدر درماتول. مه 2008 ؛ 7 (5): 463-5. [PubMed]
9
Speeckaert R، Van Gele M، Speeckaert MM، Lambert J، van Geel N. بیولوژی سندرم هایپرپیگمانتاسیون. رنگدانه سلول ملانوما Res. 2014 ژوئیه ؛ 27 (4): 512-24. [PubMed]
10
Bozzo P، Chua-Gocheco A، Einarson A. ایمنی محصولات مراقبت از پوست در دوران بارداری. می تواند پزشک خانواده 2011 ژوئن ؛ 57 (6): 665-7. [مقاله رایگان PMC] [PubMed]
11
Rendon MI ، Barkovic S. ارزیابی کلینیکی یک رژیم درمانی 4٪ هیدروکینون + 1٪ درمان رتینول برای بهبود ملاسما و فوتوداماژ در انواع پوستهای فیتزپاتریک III-VI. ج مواد مخدر درماتول. 2016 نوامبر 01؛ 15 (11): 1435-1441. [PubMed]
12
Choukem SP، Efie DT، Djiogue S، Kaze FF، Mboue-Djieka Y، Boudjeko T، Dongo E، Gautier JF، Kengne AP. تأثیر کرمهای حاوی هیدروکینون بر قند خون مویرگی قبل و بعد از شستشوی سریال در آفریقایی ها. یک نفر. 2018؛ 13 (8): e0202271. [مقاله رایگان PMC] [PubMed]
13
Enguita FJ، Leito AL. هیدروکینون: آلودگی محیط زیست ، سمیت و پاسخ می. Biomed Res Int. 2013؛ 2013: 542168. [مقاله رایگان PMC] [PubMed]
آمونیاک ، گاز بی رنگ و بوی مشخص ، یک ماده
شیمیایی بلوک ساختمان و یک جزء اصلی در ساخت بسیاری از محصولاتی است که هر روز مردم از آن استفاده می کنند. به طور طبیعی در محیط ، در هوا ، خاک و آب و گیاهان و حیوانات از جمله انسان رخ می دهد. بدن انسان با تجزیه مواد غذایی حاوی پروتئین به
اسیدهای آمینه و آمونیاک ، آمونیاک ایجاد می کند و سپس آمونیاک را به اوره تبدیل می کند.
هیدروکسید آمونیوم - که معمولاً به عنوان آمونیاک خانگی شناخته می شود - ماده ای در بسیاری از محصولات تمیز کننده خانگی روزمره است.
آمونیاک یک ساختمان اساسی برای کود نیترات آمونیوم است که نیتروژن ، ماده مغذی اساسی برای رشد گیاهان از جمله محصولات کشاورزی و چمنزار را آزاد می کند.
آمونیاک در کود
حدود 90 درصد آمونیاک تولید شده در کود برای کمک به تداوم تولید مواد غذایی برای میلیاردها نفر در سراسر جهان استفاده می شود. تولید محصولات غذایی به طور طبیعی منابع مواد مغذی خاک را کاهش می دهد. برای حفظ محصولات سالم ، کشاورزان برای ادامه تولید خاکهای خود به کودها متکی هستند. کودهای
شیمیایی همچنین می توانند به افزایش سطح مواد مغذی ضروری مانند روی ، سلنیوم و بور در محصولات غذایی کمک کنند.
به تنهایی یا به عنوان یک ماده سازنده در بسیاری از محصولات تمیز کننده خانگی ، از آمونیاک می توان برای تمیز کردن انواع سطوح خانگی - از وان ، سینک و توالت گرفته تا حمام و میزهای آشپزخانه و کاشی استفاده کرد. آمونیاک همچنین در تجزیه آهک خانگی یا لکه های چربی های حیوانی یا روغن های گیاهی مانند پخت و پز گریس و لکه های شراب موثر است. از آنجا که آمونیاک به سرعت تبخیر می شود ، معمولاً در محلول های تمیز کردن شیشه برای جلوگیری از لکه دار شدن استفاده می شود.
آمونیاک در صورت استفاده از گاز مبرد و تجهیزات تهویه مطبوع ، می تواند مقادیر قابل توجهی گرما را از محیط اطراف خود جذب کند.
آمونیاک می تواند برای تصفیه منابع آب و به عنوان بلوک ساختمانی در تولید بسیاری از محصولات از جمله پلاستیک ، مواد منفجره ، پارچه ، سموم دفع آفات و رنگها مورد استفاده قرار گیرد.
آمونیاک همچنین در فاضلاب و پساب فاضلاب ، سردخانه ، لاستیک ، پالپ و کاغذ و مواد غذایی و آشامیدنی به عنوان تثبیت کننده ، خنثی کننده و منبع نیتروژن مورد استفاده قرار می گیرد. همچنین در ساخت داروها از آن استفاده می شود
هنگام استفاده از محصولات تمیز کننده حاوی آمونیاک ، تمام دستورالعمل های موجود در برچسب محصول را رعایت کنید ، مطمئن شوید که منطقه به خوبی تهویه شده است (پنجره ها و درهای باز) و از لباس مناسب و محافظت از چشم استفاده کنید. قرار گرفتن در معرض آمونیاک باعث تحریک پوست ، چشم و ریه ها می شود. آمونیاک را با سفید کننده کلر مخلوط نکنید ، زیرا این گازهای سمی به نام کلرامین ایجاد می کند. قرار گرفتن در معرض گازهای کلرامین می تواند باعث سرفه ، تنگی نفس ، درد قفسه سینه ، حالت تهوع ، سوزش در گلو ، بینی و چشم یا ذات الریه و مایعات در ریه ها شود.
بلعیدن یک ماده تمیز کننده حاوی آمونیاک می تواند دهان ، گلو و معده را سوزاند و باعث درد شدید شکم شود. اگر یک محصول تمیز کننده حاوی آمونیاک به طور اتفاقی مصرف می شود ، برچسب محصول را برای دستورالعمل های ایمنی بخوانید ، یا با شماره تلفن 1-800-222-1222 با مرکز ملی سم تماس بگیرید ، و حتماً از این محصول تمیز کننده ، برچسب تهیه کنید.
آزمایش های پزشکی می توانند آمونیاک موجود در خون یا ادرار را تشخیص دهند. اما از آنجا که آمونیاک به طور طبیعی در محیط رخ می دهد ، افراد به طور مرتب در معرض مقادیر کم آمونیاک در هوا ، خاک و آب قرار می گیرند ، بنابراین این نتایج آزمایش به عنوان نشانگرهای زیستی مؤثر در معرض در نظر گرفتن نیست. آژانس ثبت مواد سمی و بیماریها (ATSDR) اظهار داشت: "هیچ گونه اثرات سلامتی در انسان در معرض غلظت های معمولی محیطی آمونیاک مشاهده نشده است."
حدود 90 درصد آمونیاک تولید شده در کود برای کمک به تداوم تولید مواد غذایی برای میلیاردها نفر در سراسر جهان استفاده می شود. آمونیاک کاربردهای مهم دیگری دارد. به عنوان مثال در محصولات تمیز کننده خانگی و در تولید سایر محصولات.
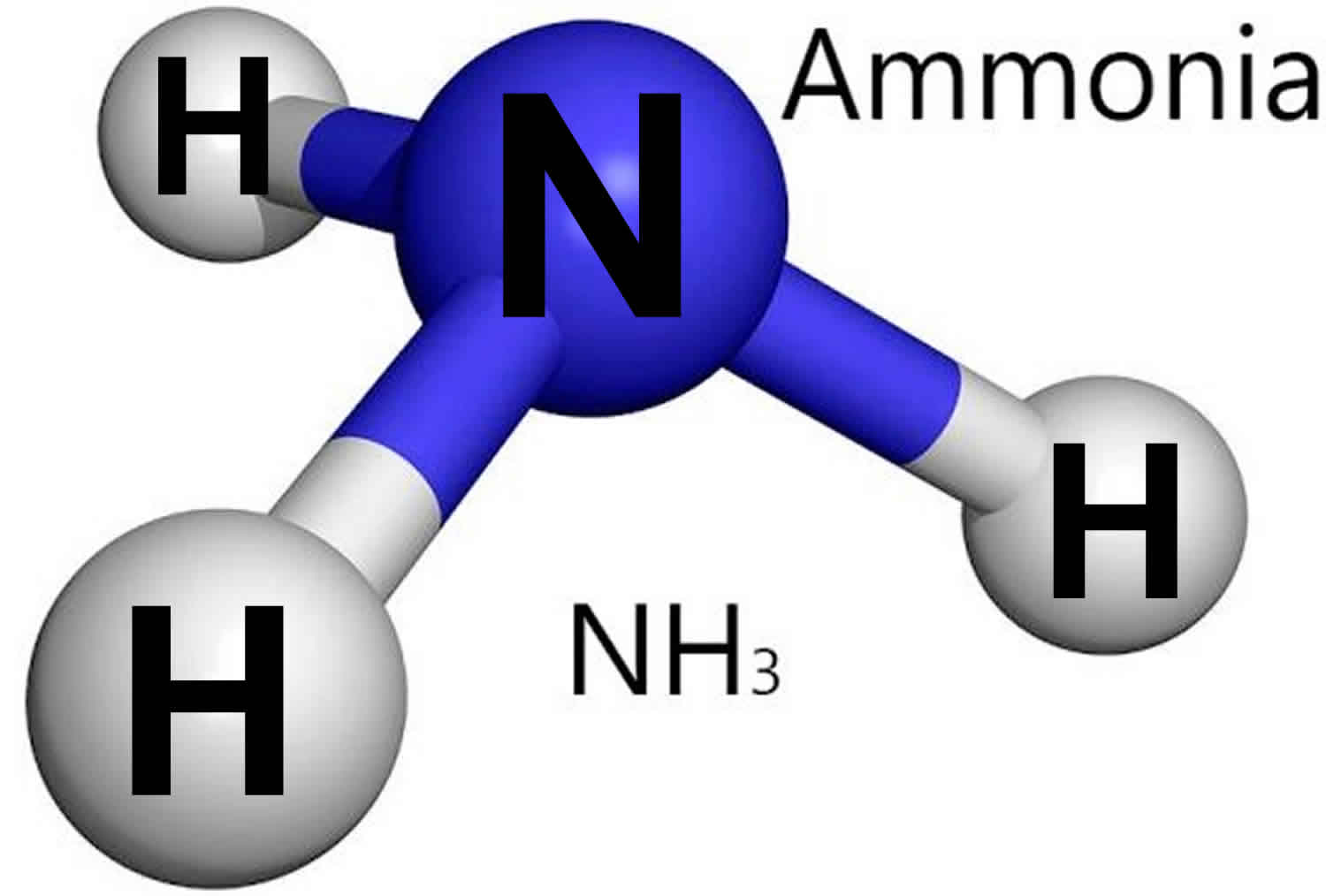
آمونیاک که به NH3 نیز معروف است ، یک گاز بی رنگ با بوی مشخص است که از اتم های نیتروژن و هیدروژن تشکیل شده است. این ماده به طور طبیعی در بدن انسان و در طبیعت - در آب ، خاک و هوا ، حتی در مولکول های باکتری های ریز تولید می شود. در سلامتی انسان ، آمونیاک و یون آمونیوم اجزای حیاتی فرآیندهای متابولیک هستند.
آمونیاک به طور طبیعی رخ می دهد و در سراسر محیط در خاک ، هوا و آب یافت می شود. آمونیاک همچنین به عنوان بخشی از چرخه نیتروژن که در حال بارور شدن گیاهان است ، به طور طبیعی تجدید می شود. در نتیجه این روند طبیعی ، آمونیاک در محیط دوام چندانی ندارد و همچنین زیست تخلیه نمی شود.
آمونیاک دارای بوی کاملاً مشخص و تند است که توصیف آن شبیه به عرق یا ادرار گربه است. پنیرهای قوی و براق مانند بری نیز می توانند مانند آمونیاک بو کنند. پنیرها حتی مقادیر کمی آمونیاک نیز در آنها وجود دارد ، به عنوان یک محصول جانبی فرایند پیر شدن پنیر.
آمونیاک به طور طبیعی در محیط رخ می دهد ، بنابراین همه در یک نقطه یا نقطه دیگر در معرض سطوح کم قرار می گیرند. این امکان وجود دارد که فرد هنگام استفاده از مواد تمیز کننده حاوی آمونیاک ، در معرض سطوح بالاتر آمونیاک باشد ، یا اگر در مزارع زندگی می کند یا در نزدیکی مزارع زندگی می کند. همچنین اگر شخصی در یک ساختمان محصور که حاوی تعداد زیادی حیوان باشد ، در معرض سطوح بالاتر آمونیاک قرار دارد.
هیچ اثر سلامتی در انسان در معرض مقادیر معمولی آمونیاک موجود در محیط یافت نشده است. قرار گرفتن در معرض مقادیر زیاد آمونیاک در هوا ممکن است برای پوست ، چشم ها ، گلو و ریه های فرد تحریک کننده باشد و باعث سرفه و سوختگی شود.
آمونیاک (NH3) یکی از رایج ترین مواد شیمیایی صنعتی در ایالات متحده است. این ماده در صنعت و تجارت مورد استفاده قرار می گیرد و همچنین به طور طبیعی در انسان و محیط نیز وجود دارد.
آمونیاک برای بسیاری از فرآیندهای بیولوژیکی ضروری است و به عنوان پیشرو در آمینو اسید و نوکلئوتیدها خدمت می کند. در محیط زیست ، آمونیاک بخشی از چرخه نیتروژن است و از طریق فرآیندهای باکتریایی در خاک تولید می شود. آمونیاک همچنین از ترکیب مواد آلی از جمله گیاهان ، حیوانات و ضایعات حیوانات به طور طبیعی تولید می شود.
در دمای اتاق ، آمونیاک یک گاز بی رنگ و تحریک کننده با بوی تند و خفه کننده است.
به شکل خالص ، به عنوان آمونیاک بی آب شناخته شده است و از نظر ریزگردی (به راحتی رطوبت را جذب می کند) است.
آمونیاک خاصیت قلیایی دارد و خورنده است.
گاز آمونیاک به راحتی در آب حل می شود تا هیدروکسید آمونیوم ، یک محلول سوز آور و پایه ضعیف تشکیل شود.
گاز آمونیاک به راحتی فشرده می شود و تحت فشار مایع شفاف قرار می گیرد.
آمونیاک معمولاً به عنوان یک مایع فشرده شده در ظروف فولادی ارسال می شود.
آمونیاک بسیار قابل اشتعال نیست ، اما ظروف آمونیاک ممکن است در معرض گرمای زیاد منفجر شوند.
آمونیاک چگونه استفاده می شود؟
حدود 80٪ آمونیاک تولید شده توسط صنعت در کشاورزی به عنوان کود استفاده می شود. آمونیاک همچنین به عنوان گاز مبرد ، برای تصفیه آب و همچنین در ساخت پلاستیک ، مواد منفجره ، پارچه ، سموم دفع آفات ، رنگها و سایر مواد شیمیایی استفاده می شود. در بسیاری از راه حل های تمیز کردن با قدرت خانگی و صنعتی یافت می شود. محلول های تمیز کننده آمونیاک خانگی با افزودن گاز آمونیاک به آب تولید می شود و می تواند بین 5 تا 10 درصد آمونیاک باشد. محلول های آمونیاک برای مصارف صنعتی ممکن است غلظت 25٪ یا بالاتر و خورنده باشند.
بیشتر افراد در اثر استنشاق گاز یا بخارات در معرض آمونیاک قرار دارند. از آنجا که آمونیاک به طور طبیعی وجود دارد و در محصولات تمیز کننده نیز وجود دارد ، ممکن است در معرض قرار گرفتن در معرض این منابع باشد. استفاده گسترده از آمونیاک در مزارع و در مکانهای صنعتی و تجاری همچنین به معنای آن است که قرار گرفتن در معرض ناشی از آزادی تصادفی یا حمله تروریستی عمدی باشد.
گاز آمونیاک بی آب از هوا سبکتر است و افزایش خواهد یافت ، به طور کلی در مناطق کم ارتفاع از بین می رود و حل نمی شود. اما ، در صورت وجود رطوبت (مانند رطوبت نسبی زیاد) ، گاز مایع آمونیاک بدون مایع بخارهایی تشکیل می شود که از هوا سنگین تر هستند. این بخارات ممکن است در امتداد زمین یا در مناطق کم ارتفاع با جریان هوا ضعیف پخش شود که در آن ممکن است افراد در معرض دید قرار گیرند.
آمونیاک بلافاصله پس از تماس با رطوبت موجود در پوست ، چشم ها ، حفره دهان ، دستگاه تنفسی و خصوصاً سطوح مخاطی تعامل برقرار می کند تا هیدروکسید آمونیوم بسیار سوز آور تشکیل شود. هیدروکسید آمونیوم باعث اختلال در نکروز بافتها از طریق اختلال در لیپیدهای غشای سلولی (ساپونی سازی) می شود که منجر به تخریب سلولی می شود. با تجزیه پروتئین های سلولی ، آب استخراج می شود ، در نتیجه یک واکنش التهابی ایجاد می شود که باعث آسیب بیشتر می شود.
استنشاق: آمونیاک تحریک کننده و خورنده است. قرار گرفتن در معرض غلظت بالای آمونیاک در هوا باعث سوزش فوری بینی ، گلو و مجاری تنفسی می شود. این می تواند باعث ورم برونشیول و آلوئولار و تخریب مجاری هوایی منجر به پریشانی یا نارسایی شود. استنشاق غلظت های پایین می تواند باعث سرفه و سوزش بینی و گلو شود. بوی آمونیاک هشدار اولیه کافی درباره حضور آن را فراهم می کند ، اما آمونیاک همچنین باعث خستگی بویایی یا سازگاری می شود و باعث کاهش آگاهی از مواجهه طولانی مدت فرد در غلظت های پایین می شود.
کودکانی که در معرض همان غلظت بخارهای آمونیاک قرار دارند ، در بزرگسالان ممکن است دوز بیشتری دریافت کنند زیرا نسبت های بیشتری از سطح وزن ریه نسبت به وزن دارند و نسبت های وزنی دقیقه با وزن بیشتر دارند. علاوه بر این ، آنها به دلیل کوتاهتر بودن قد و غلظت های بالاتر بخار آمونیاک که در ابتدا در نزدیکی زمین یافت می شوند ، در معرض غلظت های بالاتر از بزرگسالان در همان مکان هستند.
قرار گرفتن در معرض غلظت کم آمونیاک در هوا یا محلول ممکن است باعث تحریک سریع پوست یا چشم شود. غلظت بالاتر آمونیاک ممکن است باعث صدمات شدید و سوختگی شود. تماس با محلول های غلیظ آمونیاک مانند پاک کننده های صنعتی ممکن است باعث آسیب خوردگی از جمله سوختگی پوست ، آسیب دائمی چشم یا کوری شود. میزان کامل آسیب دیدگی چشم ممکن است تا یک هفته پس از مواجهه مشخص نباشد. تماس با آمونیاک مایع نیز می تواند باعث آسیب سرمازدگی شود.
بلع:
قرار گرفتن در معرض غلظت های زیاد آمونیاک از بلع محلول آمونیاک باعث آسیب خوردگی به دهان ، گلو و معده می شود. مصرف آمونیاک معمولاً منجر به مسمومیت سیستمیک نمی شود.
هیچ پادزهر برای مسمومیت با آمونیاک وجود ندارد ، اما اثرات آمونیاک قابل درمان است و بیشتر افراد بهبود می یابند. ضد عفونی فوری پوست و چشم ها با مقدار زیادی آب بسیار مهم است. درمان شامل اقدامات حمایتی است و می تواند شامل اکسیژن مرطوب ، برونکودیلاتلاتورها و مدیریت راه های هوایی باشد. آمونیاک مصرف شده با شیر یا آب رقیق می شود.
آزمایش آزمایشگاهی برای قرار گرفتن در معرض آمونیاک در تصمیم گیری در مورد اورژانس مفید نخواهد بود. آزمایشات پزشکی که می تواند آمونیاک موجود در خون یا ادرار را تشخیص دهد در دسترس است. با این حال ، از آنجا که آمونیاک به طور معمول در بدن یافت می شود ، این نتایج آزمایش نمی تواند به عنوان نشانگرهای زیستی در معرض قرار گیرد. پس از قرار گرفتن در معرض سطوح پایین ، آمونیاک یا به سرعت از بدن پاک می شود یا به ترکیباتی که بصورت درون زا در سطح قابل ملاحظه ای یافت می شود متابولیزه می شود. شاخص های بالینی سطح آمونیاک بدن یا میزان نیتروژن پس از قرار گرفتن در معرض آمونیاک برون زا هیچ تغییری یا حداقل تغییر از سطح قبلی نشان نداده اند. قرار گرفتن در معرض غلظت های بالا بلافاصله و آشکارا سمی است ، به طور کلی پایه کافی برای تشخیص فراهم می کند.
منبع :
https://www.health.ny.gov/environmental/emergency/chemical_terrorism/ammonia_tech.htm
آمونیاک ، گاز بی رنگ و بوی مشخص ، یک ماده
شیمیایی بلوک ساختمان و یک جزء اصلی در ساخت بسیاری از محصولاتی است که هر روز مردم از آن استفاده می کنند. به طور طبیعی در محیط ، در هوا ، خاک و آب و گیاهان و حیوانات از جمله انسان رخ می دهد. بدن انسان با تجزیه مواد غذایی حاوی پروتئین به
اسیدهای آمینه و آمونیاک ، آمونیاک ایجاد می کند و سپس آمونیاک را به اوره تبدیل می کند.
هیدروکسید آمونیوم - که معمولاً به عنوان آمونیاک خانگی شناخته می شود - ماده ای در بسیاری از محصولات تمیز کننده خانگی روزمره است.
آمونیاک یک ساختمان اساسی برای کود نیترات آمونیوم است که نیتروژن ، ماده مغذی اساسی برای رشد
گیاهان از جمله محصولات کشاورزی و چمنزار را آزاد می کند.
آمونیاک در کود
حدود 90 درصد آمونیاک تولید شده در کود برای کمک به تداوم تولید مواد غذایی برای میلیاردها نفر در سراسر جهان استفاده می شود. تولید محصولات غذایی به طور طبیعی منابع مواد مغذی خاک را کاهش می دهد. برای حفظ محصولات سالم ، کشاورزان برای ادامه تولید خاکهای خود به کودها متکی هستند. کودهای
شیمیایی همچنین می توانند به افزایش سطح مواد مغذی ضروری مانند روی ، سلنیوم و بور در محصولات غذایی کمک کنند.
به تنهایی یا به عنوان یک ماده سازنده در بسیاری از محصولات تمیز کننده خانگی ، از آمونیاک می توان برای تمیز کردن انواع سطوح خانگی - از وان ، سینک و توالت گرفته تا حمام و میزهای آشپزخانه و کاشی استفاده کرد. آمونیاک همچنین در تجزیه آهک خانگی یا لکه های چربی های حیوانی یا روغن های گیاهی مانند پخت و پز گریس و لکه های شراب موثر است. از آنجا که آمونیاک به سرعت تبخیر می شود ، معمولاً در محلول های تمیز کردن شیشه برای جلوگیری از لکه دار شدن استفاده می شود.
آمونیاک در صورت استفاده از گاز مبرد و تجهیزات تهویه مطبوع ، می تواند مقادیر قابل توجهی گرما را از محیط اطراف خود جذب کند.
آمونیاک می تواند برای تصفیه منابع آب و به عنوان بلوک ساختمانی در تولید بسیاری از محصولات از جمله پلاستیک ، مواد منفجره ، پارچه ، سموم دفع آفات و رنگها مورد استفاده قرار گیرد.
آمونیاک همچنین در فاضلاب و پساب فاضلاب ، سردخانه ، لاستیک ، پالپ و کاغذ و مواد غذایی و آشامیدنی به عنوان تثبیت کننده ، خنثی کننده و منبع نیتروژن مورد استفاده قرار می گیرد. همچنین در ساخت داروها از آن استفاده می شود
هنگام استفاده از محصولات تمیز کننده حاوی آمونیاک ، تمام دستورالعمل های موجود در برچسب محصول را رعایت کنید ، مطمئن شوید که منطقه به خوبی تهویه شده است (پنجره ها و درهای باز) و از لباس مناسب و محافظت از چشم استفاده کنید. قرار گرفتن در معرض آمونیاک باعث تحریک پوست ، چشم و ریه ها می شود. آمونیاک را با سفید کننده کلر مخلوط نکنید ، زیرا این گازهای سمی به نام کلرامین ایجاد می کند. قرار گرفتن در معرض گازهای کلرامین می تواند باعث سرفه ، تنگی نفس ، درد قفسه سینه ، حالت تهوع ، سوزش در گلو ، بینی و چشم یا ذات الریه و مایعات در ریه ها شود.
بلعیدن یک ماده تمیز کننده حاوی آمونیاک می تواند دهان ، گلو و معده را سوزاند و باعث درد شدید شکم شود. اگر یک محصول تمیز کننده حاوی آمونیاک به طور اتفاقی مصرف می شود ، برچسب محصول را برای دستورالعمل های ایمنی بخوانید ، یا با شماره تلفن 1-800-222-1222 با مرکز ملی سم تماس بگیرید ، و حتماً از این محصول تمیز کننده ، برچسب تهیه کنید.
آزمایش های پزشکی می توانند آمونیاک موجود در خون یا ادرار را تشخیص دهند. اما از آنجا که آمونیاک به طور طبیعی در محیط رخ می دهد ، افراد به طور مرتب در معرض مقادیر کم آمونیاک در هوا ، خاک و آب قرار می گیرند ، بنابراین این نتایج آزمایش به عنوان نشانگرهای زیستی مؤثر در معرض در نظر گرفتن نیست. آژانس ثبت مواد سمی و بیماریها (ATSDR) اظهار داشت: "هیچ گونه اثرات سلامتی در انسان در معرض غلظت های معمولی محیطی آمونیاک مشاهده نشده است."
حدود 90 درصد آمونیاک تولید شده در کود برای کمک به تداوم تولید مواد غذایی برای میلیاردها نفر در سراسر جهان استفاده می شود. آمونیاک کاربردهای مهم دیگری دارد. به عنوان مثال در محصولات تمیز کننده خانگی و در تولید سایر محصولات.
آمونیاک چیست؟
آمونیاک که به NH3 نیز معروف است ، یک گاز بی رنگ با بوی مشخص است که از اتم های نیتروژن و هیدروژن تشکیل شده است. این ماده به طور طبیعی در بدن انسان و در طبیعت - در آب ، خاک و هوا ، حتی در مولکول های باکتری های ریز تولید می شود. در سلامتی انسان ، آمونیاک و یون آمونیوم اجزای حیاتی فرآیندهای متابولیک هستند.
آمونیاک به طور طبیعی رخ می دهد و در سراسر محیط در خاک ، هوا و آب یافت می شود. آمونیاک همچنین به عنوان بخشی از چرخه نیتروژن که در حال بارور شدن گیاهان است ، به طور طبیعی تجدید می شود. در نتیجه این روند طبیعی ، آمونیاک در محیط دوام چندانی ندارد و همچنین زیست تخلیه نمی شود.
آمونیاک دارای بوی کاملاً مشخص و تند است که توصیف آن شبیه به عرق یا ادرار گربه است. پنیرهای قوی و براق مانند بری نیز می توانند مانند آمونیاک بو کنند. پنیرها حتی مقادیر کمی آمونیاک نیز در آنها وجود دارد ، به عنوان یک محصول جانبی فرایند پیر شدن پنیر.
آمونیاک به طور طبیعی در محیط رخ می دهد ، بنابراین همه در یک نقطه یا نقطه دیگر در معرض سطوح کم قرار می گیرند. این امکان وجود دارد که فرد هنگام استفاده از مواد تمیز کننده حاوی آمونیاک ، در معرض سطوح بالاتر آمونیاک باشد ، یا اگر در مزارع زندگی می کند یا در نزدیکی مزارع زندگی می کند. همچنین اگر شخصی در یک ساختمان محصور که حاوی تعداد زیادی حیوان باشد ، در معرض سطوح بالاتر آمونیاک قرار دارد.
هیچ اثر سلامتی در انسان در معرض مقادیر معمولی آمونیاک موجود در محیط یافت نشده است. قرار گرفتن در معرض مقادیر زیاد آمونیاک در هوا ممکن است برای پوست ، چشم ها ، گلو و ریه های فرد تحریک کننده باشد و باعث سرفه و سوختگی شود.
دو عنصر فراوان در پوسته زمین اکسیژن و سیلی (46.6 و 27.7 درصد وزن) هستند. در طبیعت ، سیلی تقریباً همیشه با اکسیژن ترکیب می شود. یا به طور انحصاری (به عنوان مثال در SiO2) یا در رابطه با عناصر اضافی (مانند مورد سیلیکاتها). نمونه هایی از سیلیکات ها شامل بنتونیت ها (مانند مونت موریلونیت (Al1.67Mg0.33) [(OH) 2 / Si4O10] Na0.33 (H2O) 4 ، تالک Mg3 [Si4O10 (OH) 2] و ولاستونیت Ca3 [Si3O9])) است. سیلیکاتهای طبیعی مواد اولیه اولیه را برای محصولات اصلی فنی مانند سیمان ، شیشه ، چینی و آجر تشکیل می دهند. سیلی در موجودات زنده نیز حضور دارد. تعدادی ارگانیسم وجود دارد که ساختارهایی حاوی دی اکسید سیلی ایجاد می کنند. مشهورترین نمونه ها دیاتومها (نوعی جلبک) ، رادیولارها (پلانکتون) و هگزاکتینلای (اسفنج شیشه ای) هستند. همچنین بسیاری از گیاهان حاوی دی اکسید سیلی در ساقه و برگهای آنها وجود دارد. نمونه های مشهور شامل اسب اسبی و بامبو است. این گیاهان برای دستیابی به ثبات بیشتر ، قاب هایی از دی اکسید سیلی ایجاد می کنند. محلول سیلیس محلول همچنین در آب آشامیدنی و سایر نوشیدنی هایی مانند آبجو وجود دارد (که دی اکسید سیلی آن را از جو دریافت می کند). مردم و حیوانات سیلیس را به عنوان بخشی از رژیم غذایی طبیعی خود مصرف می کنند. دی اکسید سیلی خالص می تواند به شکل آمورف یا بلورین رخ دهد. اصلاحات اصلی SiO2 که در طبیعت اتفاق می افتد در جدول 1 آورده شده است. همچنین بسیاری از ساختارهای دیگر نیز وجود دارند که SiO2 در آنها رخ می دهد. برای مرور دقیق ، به مقدمه "سیلیس" در دائرyclالمعارف شیمی صنعتی اولمان مراجعه کنید


منبع :
https://bismoot.com/blog/%D8%A7%D8%B1%D9%88%D8%B2%DB%8C%D9%84/
ویکی پدیا
https://fa.wikipedia.org/wiki/%D8%A7%D8%B1%D9%88%D8%B2%DB%8C%D9%84
آمونیاک ، که ترکیبی از نیتروژن و هیدروژن است ، اغلب به عنوان "ماده پاک کننده طبیعی" مورد استفاده قرار می گیرد ، اما این یک مورد است که طبیعی همیشه بهترین حالت را ندارد. آمونیاک به دلیل بوی بسیار تیز شناخته شده است. بو به تنهایی می تواند برای افرادی که مشکل تنفسی دارند ، باعث تحریک شود. به محض بو کردن آن ، چشمان شما ممکن است شروع به پاره شدن کند ، حتی در غلظت های کم که معمولاً برای تمیز کردن خانه ها اختصاص دارد. آنقدر قوی است بسیاری از افراد از بوی خود خاموش می شوند و تعجب می کنند که چطور چیزی که به شدت لکه دار می شود تمیز می شود تا به اندازه موثری انجام شود.
اما آمونیاک یک پاک کننده موثر است و به درستی از آن استفاده می شود ، بی خطر است.
آمونیاک می تواند به عنوان پاک کننده ای برای آینه ها و شیشه ها به طور موثری مورد استفاده قرار گیرد و نسبت به بعضی دیگر از پاک کننده ها ارزانتر است. این تنها یک مزیت برای تمیز کردن با آمونیاک است.
تمیز کردن آمونیاک : چه کاری انجام شود ، چه کاری انجام دهیم
از آمونیاک به عنوان پاک کننده کف برای کفهای بدون واکس استفاده نکنید. با گذشت زمان ، آمونیاک می تواند باعث آسیب به کف شود.
دستورالعمل های موجود در بطری را با دقت بخوانید ، زیرا باید با خیال راحت استفاده و ذخیره شود. این دستورالعمل همچنین می تواند به شما بگوید که چگونه آمونیاک را به طور موثر از بین ببرید ، و در صورت بروز حادثه با تمیز کردن آمونیاک چه کاری باید انجام دهید.
محلول های آمونیاک (5 تا 10 درصد از وزن) می توانند به عنوان یک ماده پاک کننده خانگی استفاده شوند - مخصوصاً برای شیشه.
آمونیاک برای شل شدن ذرات مواد غذایی در مایکروویوها بسیار عالی عمل می کند اما جوشاندن یک کاسه پر از آب نیز به همین خوبی کار می کند. بخار حاصل از آب ، بدون پودر آمونیاک روی غذا پخته می شود.
برای تمیز کردن اجاق گاز خود با آمونیاک ، آن را تا 150 F گرم کنید و سپس آن را خاموش کنید. 1/2 فنجان آمونیاک را درون یک کاسه ایمن فر در قفسه بالا و در زیر یک قابلمه آب جوش در قفسه قرار دهید. در را ببندید و بگذارید یک شبه بنشیند. برخی ادعا می کنند که گذاشتن یک بشقاب پر از آمونیاک یک شبه در فر باعث از بین رفتن غذای پخته شده می شود. با این حال ، ممکن است متوجه شوید که دود غیرقابل تحمل است. برای تمیز کردن ظروف خامه ای ، تمیز کننده اجاق گاز یا خمیر جوش شیرین را امتحان کنید.
منبع :
https://chemical-lab.persianblog.ir/
NITRATE SILVER چیست و چگونه کار می کند؟
نیترات نقره یک محلول موضعی با نسخه است که در معالجه زخم ها و سوختگی روی پوست به عنوان یک ماده ضد عفونی مورد استفاده قرار می گیرد.
https://bismoot.com/blog/%D9%86%D9%82%D8%B1%D9%87-%D9%86%DB%8C%D8%AA%D8%B1%D8%A7%D8%AA-silver-nitrate/
مقدار مصرف بزرگسالان و کودکان:
راه حل موضعی
0.5٪
10٪
25٪
50٪
نرم افزار میله
75٪
ملاحظات مقدار مصرف - باید به شرح زیر باشد:
احتیاط زخم ضد عفونی کننده
بزرگسالان و کودکان:
میله ها: فقط روی مناطقی که برای درمان استفاده می شود ، روی غشاهای مخاطی و سایر سطوح مرطوب پوست اعمال شود
راه حل موضعی: یک بار اعمال پنبه آغشته به محلول / پماد در منطقه آسیب دیده 2-3 بار در هفته به مدت 2-3 هفته
Supralumbar Kertaconjunctivits (برچسب خارج)
محلول 0.5-1٪ را روی تارسوس فوقانی بیهوش قرار دهید و بگذارید دوباره بر جای ملتحمه لپه آسیب دیده قرار گیرد.
بعد از 1 دقیقه با نمک استریل آبیاری کنید
ممکن است بعد از 4-6 هفته تکرار شود
home konsumer_silver_nitrate
حریم خصوصی و اطلاعات اعتماد
نام تجاری: N / A
نام عمومی: نیترات نقره
کلاس دارو: ضد میکروب های موضعی
NITRATE SILVER چیست و چگونه کار می کند؟
نیترات نقره یک محلول موضعی با نسخه است که در معالجه زخم ها و سوختگی روی پوست به عنوان یک ماده ضد عفونی مورد استفاده قرار می گیرد.
مقدار مصرف بزرگسالان و کودکان:
راه حل موضعی
0.5٪
10٪
25٪
50٪
نرم افزار میله
75٪
ملاحظات مقدار مصرف - باید به شرح زیر باشد:
احتیاط زخم ضد عفونی کننده
بزرگسالان و کودکان:
میله ها: فقط روی مناطقی که برای درمان استفاده می شود ، روی غشاهای مخاطی و سایر سطوح مرطوب پوست اعمال شود
راه حل موضعی: یک بار اعمال پنبه آغشته به محلول / پماد در منطقه آسیب دیده 2-3 بار در هفته به مدت 2-3 هفته
Supralumbar Kertaconjunctivits (برچسب خارج)
محلول 0.5-1٪ را روی تارسوس فوقانی بیهوش قرار دهید و بگذارید دوباره بر جای ملتحمه لپه آسیب دیده قرار گیرد.
بعد از 1 دقیقه با نمک استریل آبیاری کنید
ممکن است بعد از 4-6 هفته تکرار شود
سؤال
کرم حلقوی در اثر قارچ ایجاد می شود.
پاسخ را ببینید
عوارض جانبی با استفاده از نیترات شیرین بطور جداگانه ترسیم می شوند؟
عوارض جانبی نیترات نقره شامل موارد زیر است:
سوزش و سوزش پوست
رنگ آمیزی پوست
اختلال خونی (methemoglobinemia)
این سند شامل تمام عوارض جانبی احتمالی نیست و سایر موارد ممکن است رخ دهد. برای کسب اطلاعات بیشتر در مورد عوارض جانبی با پزشک خود م کنید.
تعامل سایر داروها با NITRATE SILVER چیست؟
اگر پزشک شما را راهنمایی کرده است که از این دارو استفاده کنید ، پزشک یا داروساز شما ممکن است از هرگونه فعل و انفعالات احتمالی دارویی آگاه باشد و ممکن است شما را بر روی آنها نظارت کند. قبل از مراجعه به پزشک ، ارائه دهنده مراقبت های بهداشتی یا داروساز ابتدا دوز دارویی را شروع نکنید ، متوقف کنید و یا تغییر دهید.
نیترات نقره هیچگونه تعامل شدید با سایر داروهای شناخته شده ندارد.
نیترات نقره هیچگونه تعامل جدی با سایر داروها ندارد.
https://www.rxlist.com/consumer_silver_nitrate/drugs-condition.htm
اثر متقابل نیترات نقره شامل موارد زیر است:
کلاژناز
پاپین
سولفات استامید سدیم
موضعی سولفاستامید
تریپسین
نیترات نقره هیچ تداخلی جزئی با داروهای دیگر ندارد.
این اطلاعات شامل همه فعل و انفعالات ممکن یا اثرات منفی نیست. بنابراین ، قبل از استفاده از این محصول ، تمام کالاهایی را که استفاده می کنید ، به پزشک یا داروساز خود بگویید. لیستی از تمام داروهای خود را با خود نگه دارید و این اطلاعات را با پزشک و داروساز خود در میان بگذارید. برای مشاوره پزشکی بیشتر با پزشک یا پزشک معالج خود م کنید ، یا در صورت داشتن سؤال ، نگرانی در مورد سلامتی ، یا اطلاعات بیشتر در مورد این دارو را دارید.
هشدارها و موارد احتیاط برای نیترات سیلر چیست؟
هشدارها
این دارو حاوی نیترات نقره است. در صورت حساسیت به نیترات نقره یا مواد تشکیل دهنده موجود در این دارو ، آن را مصرف نکنید.
دور از دسترس کودکان نگه دارید. در صورت مصرف بیش از حد ، بلافاصله به پزشک مراجعه کرده یا با مرکز کنترل سم تماس بگیرید.
موارد منع مصرف
حساس بودن
پوست شکسته ، زخم یا بریدگی
اثر سوء مصرف مواد مخدر
اطلاعاتی در دسترس نیست
اثرات کوتاه مدت
به "عوارض جانبی استفاده از نیترات نقره چیست؟"
اثرات بلند مدت
به "عوارض جانبی استفاده از نیترات نقره چیست؟"
هشدارها
از طولانی شدن تماس با پوست یا سایر سطوح خودداری کنید زیرا ممکن است رنگ آمیزی ایجاد شود
ممکن است باعث تحریک پوست و غشاهای مخاطی شود
بعد از استفاده از محلول 1٪ از چشم چشم آبیاری نکنید
سوختگی های شیمیایی ممکن است ناشی از استفاده نامناسب از محصول باشد
در صورت استفاده در پوست های ظریف و نازک یا نوزادان ، زمان تماس پوست با متقاضیان باید حداقل باشد
بارداری و شیردهی
در صورت سود بیشتر از خطرات ، نیترات نقره را در دوران بارداری با احتیاط مصرف کنید. مطالعات حیوانی نشان می دهد خطر و مطالعات انسانی در دسترس نیست ، یا مطالعات حیوانی و انسانی انجام نشده است.
استفاده از نیترات نقره هنگام شیردهی مورد مطالعه قرار نگرفته است. با پزشک خود م کنید.
https://bismoot.com/blog/%D9%86%D9%82%D8%B1%D9%87-%D9%86%DB%8C%D8%AA%D8%B1%D8%A7%D8%AA-silver-nitrate/
مقدمه
کیتوزان یک پلی ساکارید خطی است که از D- گلوکزامین بصورت تصادفی توزیع شده- 1- (1-4)-لینک (واحد دیاستیله شده) و N-استیل-D- گلوکزامین (واحد استیله شده) توزیع شده است. این گیاه با درمان میگو و سایر پوسته های پوسته پوسته با هیدروکسید سدیم قلیایی ساخته می شود.
کیتوزان دارای تعدادی کاربرد تجاری و احتمالی زیست پزشکی است. این گیاه می تواند در کشاورزی به عنوان یک گیاه بذر و بیولوژیک سم مورد استفاده قرار گیرد و به گیاهان برای مقابله با عفونت های قارچی کمک می کند. در شراب سازی می توان از آن به عنوان ماده ریزشی استفاده کرد ، همچنین به جلوگیری از فساد کمک می کند. در صنعت می توان از یک پوشش رنگ پلی اورتان خوددرمانی استفاده کرد. در پزشکی ممکن است برای کاهش خونریزی و به عنوان یک ماده ضد باکتری در بانداژها مفید باشد. همچنین می تواند برای کمک به رساندن دارو از طریق پوست استفاده شود.
بحث برانگیزتر ، ادعا شده است که کیتوزان در محدود کردن جذب چربی از آن استفاده می کند ، که این امر می تواند برای رژیم های غذایی مفید باشد ، اما شواهدی در این باره وجود دارد.
از دیگر کاربردهای کیتوزان که مورد تحقیق قرار گرفته است ، استفاده از آن به عنوان یک فیبر رژیم غذایی محلول است.
توابع و برنامه ها
درجه پزشکی:
1. ترویج انعقاد خون و بهبود زخم؛
2. به عنوان ماتریس رهاسازی دارو استفاده می شود.
3. در بافت ها و اندام های مصنوعی استفاده می شود.
4- بهبود سیستم ایمنی ، محافظت در برابر فشار خون ، تنظیم قند خون ، ضد پیری ، تقویت اسید اسید و غیره ، "
درجه مواد غذایی: 1. ماده ضد باکتری
2. مواد نگهدارنده میوه و سبزیجات
3. مواد افزودنی برای مواد غذایی بهداشتی
4. عامل روشن کننده آب میوه "
درجه کشاورزی: 1. در کشاورزی ، کیتوزان به طور معمول به عنوان یک گیاه بذر طبیعی و تقویت کننده گیاهان مورد استفاده قرار می گیرد ، و به عنوان یک ماده بیولوژیکی دوستدار محیط زیست که توانایی ذاتی گیاهان را برای دفاع در برابر عفونت های قارچی تقویت می کند.
2. به عنوان افزودنی های خوراکی ، می توانند باکتری مضر را مهار و از بین ببرند ، ایمنی حیوانات را بهبود می بخشند. "
3. درجه صنعتی: 1. کیتوزان دارای خصوصیات خوبی برای جذب یون فات سنگین است که در تصفیه فاضلاب آلی ، فاضلاب رنگ ، تصفیه آب و صنعت نساجی کاربرد دارد.
2. از کیتوزان می توان در صنعت کاغذ سازی نیز استفاده کرد و باعث بهبود مقاومت خشک و مرطوب کاغذ و چاپ سطح می شود. "
درجه محلول در آب: کیتوزان با درجه محلول در آب از کیتوزان از طریق کربوکسیلاسیون ، آزادانه در آب محلول و شخصیت پایدار است. دارای رطوبت عالی ، حفظ رطوبت ، اپسونیزه کردن ، مهار باکتری ها و غیره است که قابل استفاده در لوازم آرایشی مختلف مانند کرم نرم کننده ، ژل دوش ، کرم تمیز کننده ، موس ، سرمازدگی پیشرفته پماد ، مواد آرایشی امولسیون و کلوئیدی و غیره همچنین در مورد مرطوب کننده و ماده ضد انعطاف پذیر مواد غذایی ، میوه و سبزیجات ، فلوکولنت برای تصفیه فاضلاب ، ماده ترشح پایدار دارو ، چسب غیر سمی ، کمکی برای رنگ آمیزی و چاپ و کاغذ و غیره
Carboxymethyl Chitosan: Carboxymethyl Chitosan بزرگتر شدن کیتوزان است که دارای 100٪ محلول در آب ، قابلیت شکل گیری فیلم ، قالب گیری فات سنگین است. این ماده در لوازم آرایشی پیشرفته ، عامل کلاتینگ فات سنگین ، ماده ترکیب پایدار دارو ، عامل تنظیم کننده رشد گیاهان ، تصفیه فاضلاب و غیره استفاده شده است
https://bismoot.com/blog/%da%a9%db%8c%d8%aa%d9%88%d8%b3%d8%a7%d9%86/
سیکلوهگزان یک سیکلوکلان با فرمول مولکولی C6H12 است. سیکلوهگزان به عنوان یک حلال غیر قطبی در صنایع شیمیایی و همچنین به عنوان ماده اولیه برای تولید صنعتی اسید چربی و کپرولاکتام مورد استفاده قرار می گیرد که هر دو واسطه ای هستند که در تولید نایلون مورد استفاده قرار می گیرد. در مقیاس صنعتی ، سیکلوهگزان با واکنش بنزن با هیدروژن تولید می شود. به دلیل خاصیت شیمیایی و سازه منحصر به فرد ، سیکلوهگزان نیز در آزمایشگاه ها در تجزیه و تحلیل و به عنوان استاندارد مورد استفاده قرار می گیرد.
مولکول سیکلوهگزان با استفاده از Jsmol مراجعه کنید - برای ساختارهای سه بعدی
6 حلقه مهره با شکل شش ضلعی کامل مطابقت ندارد. ترکیب یک شش ضلعی مسطح 2D مسطح ، دارای کرنش زاویه قابل توجهی به دلیل عدم وجود اوراق قرضه آن 109.5 درجه است. فشار چرخشی نیز به دلیل تمام اوراق قرضه خارج شده قابل توجه خواهد بود. بنابراین ، برای کاهش فشار پیچشی ، سیکلوهگزان یک ساختار سه بعدی را ایجاد می کند که به عنوان ترکیب صندلی شناخته می شود. ترکیب جدید ، کربن ها را در زاویه 109.5 درجه سانتیگراد قرار می دهد. نیمی از هیدروژن ها در صفحه رینگ (استوایی) قرار دارند در حالی که نیمی دیگر عمود بر صفحه (محوری) است. این ترکیب پایدارترین ساختار سیکلوهگزان را فراهم می کند. یکی دیگر از ترکیبات سیکلوهگزان وجود دارد ، که به عنوان ترکیب قایق شناخته می شود ، اما در شکل گیری صندلی کمی پایدارتر متصل می شود. اگر سیکلوهگزان با یک جایگزین بزرگ جایگزین شود ، بنابراین احتمالاً ماده جایگزین در موقعیت استوایی متصل می شود ، زیرا این ترکیب کمی با ثبات تر است.
سیکلوهگزان کمترین میزان زاویه و فشار پیچشی مربوط به کلیه سیکلوکلان ها را دارد ، در نتیجه سیکلوهگزان 0 از نظر فشار حلقه در کل ، ترکیبی از زاویه و کرنش چرخشی در نظر گرفته شده است. این امر همچنین باعث می شود سیکلو هگزان پایدار ترین سیکلوکلان ها باشد و بنابراین در هنگام سوختن در مقایسه با دیگر سیکلوکلان ها کمترین میزان حرارت ایجاد می کند.
یک مولکول سیکلوهگزان در ساختار صندلی. اتم های هیدروژن در موقعیت های محوری به رنگ قرمز نشان داده شده اند ، در حالی که آنهایی که در موقعیت های استوایی قرار دارند به رنگ آبی هستند.
سیکلو هگزان خالص به خودی خود غیر واکنشی است ، که یک هیدروکربن غیر قطبی و آبگریز است. این ماده می تواند با اسیدهای بسیار قوی مانند سیستم فوق العاده HF + SbF5 واکنش نشان دهد و این امر باعث ایجاد پروتئین اجباری و "ترک خوردگی هیدروکربن" می شود. با این حال ، سیکلو هگزانهای جایگزین ممکن است تحت شرایط مختلف واکنش پذیر باشند ، که بسیاری از آنها برای شیمی آلی مهم هستند. سیکلوهگزان بسیار قابل اشتعال است.
ترتیب خاص گروههای عملکردی در مشتقات سیکلوهگزان ، و در واقع در بیشتر مولکولهای سیکلوکلان ، در واکنشهای شیمیایی به ویژه واکنشهای مربوط به نوکلئوفیلها بسیار مهم است. مواد تشکیل دهنده زیر حلقه باید در شکل محوری باشند تا با سایر مولکول ها واکنش نشان دهند. به عنوان مثال ، واکنش برموسیکلو هگزان و یک نوکلئوفیل مشترک ، آنیون هیدروکسید منجر به سیکلو هگزن می شود.
این واکنش ، که معمولاً به عنوان یک واکنش از بین بردن یا dehalogenation شناخته می شود (به طور خاص E2) ، نیاز دارد که جانشین برم در تشکیل محوری باشد و در مقابل یک اتم H محوری دیگر برای واکنش قرار گیرد. با فرض اینکه برموسیکلو هگزان در تشکیل مناسب برای واکنش قرار داشته باشد ، واکنش E2 به این ترتیب آغاز می شود:
پیوند جفت الکترونی بین C-Br به Br منتقل می شود ، Brˆ را تشکیل می دهد و آن را از سیکلوهگزان آزاد می کند.
نوکلئوفیل (-OH) یک جفت الکترون را به محور H محور مجاور می دهد ، H را آزاد می کند و برای ایجاد H2O به آن پیوند می زند.
پیوند جفت الکترون بین محوری H مجاور به پیوند بین دو C-C حرکت می کند و آن را C = C می کند
توجه: هر سه مرحله به طور همزمان اتفاق می افتند ، مشخصه همه واکنش های E2.
واکنش فوق اکثر واکنشهای E2 را ایجاد می کند و در نتیجه محصول بیشتر (70٪)) سیکلوهگزن خواهد بود. با این حال ، درصد با شرایط متفاوت است و به طور کلی ، دو واکنش متفاوت (E2 و Sn2) با یکدیگر رقابت می کنند. در واکنش فوق ، یک واکنش Sn2 به جای آن ، برم را برای گروه هیدروکسیل (OH-) جایگزین می کند ، اما یک بار دیگر ، Br باید در محوری باشد تا واکنش نشان دهد. پس از تکمیل تعویض SN2 ، گروه OH که به تازگی جایگزین شده است ، به سرعت به موقعیت استوایی پایدارتر برمی گردد (1 میلی ثانیه پوند).
از نظر تجاری اکثر سیکلوهگزان تولید شده توسط اکسیداسیون کاتالیزوری به مخلوط سیکلوهگزانون-سیکلوهگزان تبدیل می شود. روغن KA سپس به عنوان ماده اولیه برای اسید چربی و کپرولاکتام استفاده می شود. از نظر عملی ، اگر محتوای سیکلوهگزانول روغن KA بیشتر از سیکلوهگزانون باشد ، احتمالاً (اقتصادی) به اسید چربی تبدیل می شود ، و مورد مع ، تولید کاپرولاکتام محتمل است. چنین نسبی در روغن KA با انتخاب کاتالیزهای اکسیداسیون مناسب قابل کنترل است. برخی از سیکلو هگزان به عنوان یک حلال آلی استفاده می شود.
خزه ها را می توان از منطقه قطب شمال به کلیه مناطق استوایی و بخش های قطب جنوب یافت. حتی اگر آنها بیشتر در مناطق مرطوب و سایه دار در آب و هوای معتدل زندگی می کنند ، برخی در بیابان ها زنده می مانند و برخی دیگر در باتلاق ها و نهرها زندگی می کنند. در نتیجه خزه را می توان به عنوان علفهای هرز آبی مانند علفهای هرز پتو دسته بندی کرد.
در جنگل ها ، خزه ها معمولاً حصیری را تشکیل می دهند که در زمین یا سطوح درختان درخت پوسیده ساکن است.
خزه ها قادر به ذخیره مقادیر زیادی آب در سلول های خود هستند ، اما اگر خشکسالی برای مدت طولانی ادامه یابد ، تا زمانی که باران ببارد ، خفته می شوند. بیشتر خزه ها با قطعه قطعه شدن به صورت غیر تجربی بازتولید می شوند. در اصل ، هر بخشی از گیاه خزه می تواند رشد کند و تولید برگهای برگ شود.
در حالی که روش های بسیاری برای کنترل خزه وجود دارد ، یک محصول ارگانیک / طبیعی واحد وجود دارد که یک قاتل موثر ، سولفات آهن است.
برای خرید سولفات آهن به شرکت بیسموت از طریق لینک زیر اقدام کنید :
https://bismoot.com/blog/%d8%b3%d9%88%d9%84%d9%81%d8%a7%d8%aa-%d8%a2%d9%87%d9%86/
سولفات آهن که به آن سولفات آهن یا سولفات آهن نیز می گویند نوعی نمکی است که به عنوان هپتیدرات وجود دارد. Heptahydrate یک ترکیب شیمیایی است که دارای هفت مولکول آب است دقیقاً مشابه سولفات منیزیم. فرمول شیمیایی آن FeSO4 است.
سولفات آهن آلی سولفات در صنایع متنوعی از جمله بخش پزشکی ، تولیدی و باغداری مورد استفاده قرار می گیرد. از سولفات آهن نیز به عنوان کود دانه ای استفاده می شود.
استفاده از سولفات آهنی به عنوان یک قاتل خزه به اسیدی شدن خاکهای قلیایی کمک می کند تا شرایط ایده آل برای طیف وسیعی از گیاهان فرسایش فراهم کند. همچنین این ماده برای کنترل خزه و جلبک و همچنین به عنوان یک ماده مؤثر در ماسه چمن و پانسمانهای چمن ، مؤثر و مقرون به صرفه است.
آهن باعث سیاه شدن خزه می شود. در حقیقت ، سولفات آهن باعث ایجاد اثر سوختگی روی خزه می شود تا گیاه شکننده شود و در نهایت بمیرد. از آنجا که سولفات آهن برای استفاده به عنوان کود مناسب است ، از مزایای چمن شما و سبزتر شدن آن بهره می برد. در اصل ، این یک مکانیسم انتخابی دارد که فقط خزه را هدف قرار می دهد.
نکته کلیدی مهم که باید در نظر داشته باشید این است که خزه چمنزارها را نمی کشد بلکه روی سطح چمن رشد می کند. با گذشت زمان ، چمن باید برای رقابت در برابر نور آفتاب که می تواند باعث گم شدن چمن شود ، سخت تلاش کند. علاوه بر این ، خزه فرصت طلب است و در جایی که علف وجود ندارد شکوفا می شود.

moss-killer-sulphate این سولفات آهنی بهترین و محبوب ترین مورد در انگلستان است. این بررسی های عجیب و غریب در مجموع نزدیک به 400 رتبه پنج ستاره است. این محصول بسیار مؤثر است و برای خلاصی از خزه کار می کند اما چمن را سالم نگه می دارد. علاوه بر این ، این قدرت را دارد که چمن شما سبزتر به نظر برسد.
قبل از شروع به کار با استفاده از چمن یا باغ خود ، باید چمن را هوادهی کنید تا برگهای مرده و خارش را جدا کنید. یک روسری خوب کار را انجام داده و زمینه را برای کاربرد سولفات آهن آماده می کند.
دو روش استفاده از سولفات آهنی در چمن و باغ شما می تواند از طریق دستگاه پخش یا اسپری باغ باشد.
بهترین زمان استفاده از سولفات آهن در فصل بهار یا پاییز است.
با استفاده از دستگاه چمن زنی چمن ، چمن را هوادهی کرده و پوشش گیاهی مرده و خارش را از بین ببرید.
انتخاب کنید آیا می خواهید از سمپاش یا پخش کننده باغ استفاده کنید (بررسی سمپاشهای باغ ما را بررسی کنید یا پخش کننده همیشه سبز را انتخاب کنید). دستگاه پخش کننده Evergreen برای پخش محصولات چمن زنی به منظور افزایش مناسب سولفات آهن است. از نظر ما ، استفاده از سمپاش باغ را توصیه نمی کنیم زیرا اغلب نمک حاصل از سولفات آهن به خوبی با آب مخلوط نمی شوند و منجر به نازل مسدود شده می شوند.
اگر تصمیم به استفاده از سمپاش دارید ، یک روز را انتخاب کنید که باد کمی وجود داشته باشد و اطمینان حاصل کنید که باران در طی 24 ساعت سقوط نخواهد کرد. برای استفاده ، 17 میلی لیتر سولفات آهنی اندازه گیری کرده و آن را با 4.5 لیتر آب گرم مخلوط کنید. این مخلوط قادر به درمان 200 متر مربع خواهد بود. بعد ، سمپاش خود را قرار داده و مناطق آسیب دیده را درمان کنید.
اگر تصمیم به استفاده از پخش کننده دارید ، باید ناحیه مورد استفاده را به طور کامل آب دهید یا اجازه دهید باران پس از استفاده ، این کار را برای شما انجام دهد. هیچ محدودیتی در رابطه با آب و هوا از این روش استفاده نمی کند. برای استفاده: سولفات آهن را به دو نیم تقسیم کنید ، پخش کننده را با ماده کافی پر کنید و شروع به پخش پهن بر روی چمن کنید.
پس از اینکه خزه مرده است ، چمن را مجدداً زخم بریزید و یا از جاروبرقی برای پاک کردن زباله های اضافی استفاده کنید.
میزان اسیدیته خاک را با کیت تست pH خاک بررسی کنید. بهترین pH خاک برای چمن بین 6.5 تا 7 است. اگر pH خاک شما بالاتر از 7 باشد ، خیلی قلیایی است ، و اگر زیر 6.5 باشد ، خیلی اسیدی است.
برای خنثی کردن سطح pH خاک 5 تا 10 پوند آهک در 100 متر مربع بکار ببرید (با توجه به اینکه آزمایش نشان می دهد خاک اسیدی است).
کمپوست آلی را برای بارور کردن چمن یا باغ اضافه کنید.
برای تمیز کردن نیز میتونید از آمونیاک استفاده کید که در مطلب زیر میتوانید آن را بخوایند :
http://copper-sulfate.blog.ir/1398/12/13/%D9%87%D9%85%D9%87-%DA%86%DB%8C%D8%B2-%D8%AF%D8%B1%D8%A8%D8%A7%D8%B1%D9%87-%D8%AA%D9%85%DB%8C%D8%B2-%DA%A9%D9%86%D9%86%D8%AF%D9%87-%D8%A8%D8%A7-%D8%A2%D9%85%D9%88%D9%86%DB%8C%D8%A7%DA%A9
برای دستیابی به حداکثر ایمنی هنگام کار با سولفات آهنی ، از این نشانگرها پیروی کنید
به نظر می رسد تولیدکنندگان سولفات آهن حلقوی برای جلوگیری از اقدام قانونی برای محصولاتشان استفاده می کنند. طبق قانون ، هر نوع سموم دفع آفات ، چه علف کش ، قارچ کش ، یا قاتل قاتل ، نیاز به ثبت نام در دفتر بهداشت و ایمنی انگلستان دارد. صید سولفات آهن می تواند به عنوان کود یا قاتل قارچ به بازار عرضه شود.
شرکت هایی که سولفات آهن را به عنوان یک قاتل خزه بازاریابی می کنند ، ابتدا باید از دولت تصویب شوند. با این حال ، شرکت هایی که سولفات آهن را به عنوان کود بازاریابی می کنند ، به هیچ مجوزی احتیاج ندارند. در تئوری ، سولفات آهنی موجود در این محصولات یکسان است اما با هدف متفاوت و قیمت متفاوتی به بازار عرضه می شود.
خزه با چمن سالم رقابت خوبی ندارد. و اگر از سولفات آهنی برای ایجاد یک باغ یا حیاط سرسبز استفاده می کنید ، ارزش پول خود را به دست می آورید. با این حال ، هنگام درمان خزه باید تمام فاکتورهای رشد مؤثر مانند فصل ، آب و هوا ، سطح سایه ، میزان باران ، نوع خاک و محتوای مغذی خاک را در نظر گرفت. با نزدیک شدن به مشکلات باغ به صورت جامع ، می توانید موفقیت خود را به عنوان یک باغبان تضمین کنید.
ترجمعه شده از :
http://weedicide.co.uk/iron-sulphate-moss-killer/
متیلن کلرید یک حلال است که در نوارهای رنگی و لاکی یافت می شود و برای از بین بردن پوشش های رنگی یا لاک از سطوح مختلف استفاده می شود. همچنین در پالایش وان استفاده می شود.
آژانس حفاظت از محیط زیست ایالات متحده (EPA) یک قانون نهایی را صادر کرد که ممنوعیت استفاده از متیلن کلرید در کلیه مواد پاک کننده رنگ برای مصارف مصرف کننده ، در تاریخ 24 نوامبر 2019 است.
متیلن کلرید برجسته ترین مورد استفاده در صنعت است - در تولید نوارهای رنگی ، دارویی و حلالهای فرآیندی. متیلن کلرید همچنین در تنظیمات صنعتی زیر استفاده می شود:
متیلن کلرید به عنوان یک حلال استخراج در صنایع تولید مواد غذایی و آشامیدنی استفاده می شود. به عنوان مثال ، متیلن کلراید می تواند برای از بین بردن کافئین از دانه های قهوه خنک نشده و برگ های چای ، برای تهیه قهوه و چای بدون کافئین استفاده شود.
متیلن کلرید همچنین در فرآوری ادویه ها ، ایجاد عصاره هوپس برای آبجو و سایر طعم دهنده های صنایع غذایی و آشامیدنی استفاده می شود.
https://bismoot.com
از متیلن کلراید می توان برای جدا سازی سطوح و قطعات فی مانند قطعات هواپیما و مسیرهای ریلی و تجهیزات استفاده کرد. روغن کاری و چربی زدایی مورد استفاده در محصولات خودرو ، به عنوان مثال در برداشتن واشر و آماده سازی قطعات فی برای واشر جدید ، می تواند حاوی متیلن کلرید باشد.
متخصصان خودرو از فرآیند جدا سازی بخار متیلن کلرید بخار برای از بین بردن روغن و گریس از قطعات ترانزیستور خودرو ، موتورهای دیزلی و اجزای هواپیما و مجموعه های فضاپیما استفاده می کنند.
تکنیک های مدرن دفع بخار که متکی به کلرید متیلن هستند ، باعث می شوند قطعات فی در سیستم های حمل و نقل به سرعت و با اطمینان تمیز شوند.
استفاده از سولفات آهن به عنوان قاتل خزه را نیز بخوانید
در آزمایشگاه ها از متیلن کلراید برای استخراج مواد شیمیایی از گیاهان یا مواد غذایی برای داروهایی مانند استروئیدها ، آنتی بیوتیک ها و ویتامین ها استفاده می شود.
تجهیزات پزشکی را می توان به سرعت و کارآمد با پاک کننده های متیلن کلرید بدون ایجاد مشکلات خوردگی یا آسیب رساندن به قطعات حساس به گرما تمیز کرد.
https://saferchemicals.org/get-the-facts/toxic-chemicals/methylene-chloride/

اداره ایمنی و بهداشت کار در ایالات متحده (OSHA) متیلن کلرید را در تنظیمات صنعتی نظارت و تنظیم می کند. متیلن کلرید استاندارد OSHA حد مجاز در معرض 25 قسمت از متیلن کلرید در هر میلیون قسمت هوا در طی یک دوره هشت ساعته را تعیین می کند. کارفرمایان باید از اامات OSHA که برای حفاظت از کارگر استفاده می شود ، از جمله حفظ تهویه مناسب و استفاده از دستگاه تنفس و سایر تجهیزات ایمنی استفاده کنند.
هنگامی که از متیلن کلرید در فرآوری مواد غذایی و آشامیدنی استفاده می شود ، سازمان غذا و داروی ایالات متحده (FDA) مقدار مواد شیمیایی موجود در مواد غذایی را محدود می کند.
EPA دارای خلاصه خطر خطر متیلن کلرید است. حوادث مسمومیت با متیلن کلرید در حین عملیات سلب کردن رنگ و پالایش وان حمام نشان داده است که قرار گرفتن در معرض استنشاق در مقادیر بسیار بالا می تواند برای انسان کشنده باشد.
در تاریخ 24 نوامبر 2019 ، تولید (شامل واردات) ، فرآوری ، توزیع یا فروش متیلن کلرید در حذف کننده های رنگ برای مصرف کننده غیرقانونی خواهد بود. سازمان حفاظت محیط زیست استفاده از مواد شیمیایی را در نوارهای رنگی برای خطرات غیر منطقی برای سلامتی انسان یافت. تنفس در مقادیر زیادی از متیلن کلرید ، به ویژه در فضاهای بسته و بدون تهویه کافی ، می تواند کشنده باشد. قرار گرفتن در معرض متیلن کلراید همچنین می تواند باعث سرگیجه و سوختگی پوست یا ایجاد قرمزی شود. اطلاعات دقیق تری را می توانید در برگه اطلاعات ایمنی سازنده مشاهده کنید.
استفاده از متیلن کلرید در کاربردهای تجاری باید مطابق با دفع محل کار و سایر اامات نظارتی محیط باشد
https://www.laballey.com/collections/methylene-chloride
ممنوعیت EPA در مورد حذف متیلن کلرید برای استفاده در مصرف کنندگان در تاریخ 24 نوامبر 2019 اعمال می شود. این ممنوعیت به مؤسسات از جمله سایت های تجارت الکترونیکی نیاز دارد تا فروش محصولات حذف رنگ حاوی متیلن کلرید را به طور دائم به فروش برساند.
EPA همچنین در حال کار بر روی تصمیم گیری در آینده است که می تواند یک برنامه آموزشی ، صدور گواهینامه و دسترسی دسترسی محدود به متیلن کلرید برای مصارف تجاری ، دارای مجوز فدرال باشد.
سازمان حفاظت محیط زیست مستم آن است که انتشار متیلن کلرید به میزان 1000 پوند یا بیشتر به دولت فدرال گزارش شود. سازمان حفاظت محیط زیست همچنین دستورالعمل هایی را در مورد میزان متیلن کلرید فرد در مدت زمان مشخصی "بدون ایجاد خطر برای سلامتی انسان" در معرض خطر قرار می دهد.
OSHA حد مجاز قرار گرفتن در معرض مجاز برای متیلن کلرید را برای کارگران تعیین کرده است. در محصولات غذایی مانند ادویه جات ترشی جات ، عصاره هوپس برای آبجو و قهوه بدون کافئین و چای ، FDA محدودیت هایی در میزان متیلن کلرید ایجاد کرده است که می تواند در یک محصول باقی بماند. براساس قانون مواد خطرناک فدرال ، کمیسیون ایمنی کالاهای مصرفی برای محصولات حاوی متیلن کلرید نیاز به برچسب زدن دارد
https://www.chemicalsafetyfacts.org/methylene-chloride/
محلول هیدروکسید پتاسیم (آبی KOH) یک مایع معدنی بی رنگ است که به عنوان یک پایه قوی (قلیایی) عمل می کند. محلول KOH همچنین به عنوان آب پوزه یا پتاس سوز آور شناخته شده است و کاربردهای مختلفی دارد. در طی فرآیند تولید مایع KOH ، کلر و هیدروژن به عنوان محصولات مشترک تشکیل می شوند.
https://bismoot.com/blog/پتاسیم-هیدروکسید/
Vynova مایع پتاس سوز آور را در انواع مختلفی از غلظت ها ، از محلول استاندارد 45-50 to تا هر غلظت دیگر در صورت درخواست ، تهیه می کند. به لطف ظرفیت گسترده و شبکه توزیع ما ، ما قادر به تهیه بازار از مکانهای استراتژیک متعددی هستیم.
محلول هیدروکسید پتاسیم کاربردهای گسترده ای در صنایع مختلف دارد ، از مواد غذایی ، مراقبت از مصرف کننده و داروسازی گرفته تا کشاورزی و ساخت شیشه. همچنین در تولید باتری های قلیایی و همچنین در تولید بیودیزل و همچنین دسیترهای مخصوص باند فرودگاه از الکترولیت استفاده می شود.
علاوه بر این ، لیز KOH واسطه ای در تهیه فرآورده های مراقبت شخصی مانند لوسیون مایع ، صابون و شامپو است. به عنوان یک پایه قوی ، با چربی و چربی ها واکنش نشان می دهد و آن را به عنوان یک ماده مفید در پاک کننده های زهکشی و فر و همچنین در مواد شوینده غیر فسفات تبدیل می کند.
https://www.sigmaaldrich.com/catalog/substance/potassiumhydroxide5611131058311
پتاس سوز آور به دلیل دارا بودن شاخص نمک کم و حلالیت بالا ، در تولید مخلوط کود مایع نیز مؤثر است. مایع KOH به منظور افزایش عملکرد محصول و بهبود تحمل به خشکی محصولات زراعی شناخته می شود.
پتاسیم هیدروکسید KOH برای تولید بیودیزل ، سلول های سوختی و صابون های مایع. با کیفیت بالا ، درجه بالا. 90٪ پوسته های خالص. مترادف: Caustic potash؛ هیدرات پتاسیم همچنین برای استفاده در کاربردهای خاص مانند ژنراتورهای هیدروژن. همه محصولات در ظروف HPDE قابل استفاده آسان و قابل حمل ارسال می شوند (در هر ظرف 2 پوند پتاس ارسال می شود). این محموله به عنوان کالای مصرف کننده ORM-D طبقه بندی می شود. بسته بندی ما با کلیه نیازهای قابل اجرا از بخش حمل و نقل ایالات متحده دیدار می کند. ما یک ارسال کننده تایید شده را داریم و این محصول را در بسته بندی های ایمن و قانونی توسط یک شرکت حمل قانونی می فرستیم.
https://www.amazon.com/Potassium-Hydroxide-Caustic-Anhydrous-Electrolyte/dp/B001EDK0WK
دی اتانول آمین یک ترکیب ارگانیک مایع بی رنگ است که در دمای اتاق یک جامد سفید است. فرمول شیمیایی آن C4H11NO2 است. CAS # آن 111-42-2 است.
از دی اتانول آمین به طور گسترده ای برای تهیه دی اتانول آمیدها و نمک های دی اتانول آمین اسیدهای چرب با زنجیره بلند که در صابون ها و سورفاکتانتهای مورد استفاده در مواد شوینده مایع و ظرفشویی ، مواد آرایشی ، شامپو و نرم کننده مو استفاده می شود ، استفاده می شود. دی اتانول آمین همچنین در پردازش نساجی و همچنین در تصفیه گاز صنعتی برای از بین بردن گازهای اسیدی کاربرد زیادی دارد. این ماده ضد خوردگی در مایعات فکاری و آماده سازی مواد شیمیایی کشاورزی است.
DEA یک کریستال سفید مایع روغنی و بی رنگ یا سفید است و دارای کمی فاسد ماهی و بوی آمونیاک است. در آب و اتانول بسیار محلول است و در اتیل اتر و بنزن کمی محلول است.
مانند تمام اتانول آمین ها ، دی اتانول آمین به طور انحصاری با واکنش اتیلن اکسید با آمونیاک اضافی به صورت صنعتی تولید می شود.

کلر
تولید کلر:
بیشتر کلرها توسط فن آوری جیوه ، دیافراگم یا سلول های غشایی بصورت الکترولیتی تولید می شوند. در هر فرآیند ، محلول کلرید سدیم با عملکرد جریان الکتریکی مستقیم ، که یون های کلرید را به کلر عنصری تبدیل می کند ، الکترولیز می شود.
کلر به روش های دیگری نیز تولید می شود ، به عنوان مثال ، با الکترولیز آب نمک کلرید پتاسیم در سلول های غشایی و جیوه با تولید هیدروکسید پتاسیم. از طریق الکترولیز سدیم مذاب یا کلرید منیزیم برای ساختن سدیم یا ف منیزیم عنصری. با الکترولیز اسید هیدروکلریک؛ و توسط فرآیندهای غیر الکترولیتی.
برنامه های کاربردی کلر:
استفاده از کلر به عنوان ماده تصفیه کننده برای ضد عفونی کردن آب برای اهداف آشامیدنی و شنا کاملاً شناخته شده است. با این حال کلر یک ساختمان اساسی در صنعت مواد شیمیایی است و منجر به بی شماری از مواد می شود که برای ساخت محصولاتی که هر روز از آن استفاده می کنیم برای سلامتی ، ایمنی ، تغذیه ، امنیت ، حمل و نقل ، شیوه زندگی و نوآوری های پیشرفته است. در حقیقت ، محصولات کلر از انواع و محصولات مشتق کلر 45٪ از تولید ناخالص داخلی کشور را تشکیل می دهد.
لیست برنامه های کاربردی کلر شامل موارد زیر است:
اتومبیل ، به عنوان مثال داشبورد ، صندلی فوم ، رنگ خودرو ، پارچه
ساخت و ساز ، به عنوان مثال لوله ، کفپوش ، رنگهای داخلی و خارجی ، نمای سایدینگ
حمل و نقل ، به عنوان مثال موتورهای جت ، موشک ها ، چتر نجات ها ، هواپیماهای تیتانیومی
الکترونیک ، به عنوان مثال نیمه هادی ها ، دیسک های رایانه ای ، عایق سیم
تولید مواد غذایی ، به عنوان مثال بسته بندی های استریل ویتامین ها ، پاک کننده ها ، ضد عفونی کننده ها
مراقبت های بهداشتی ، به عنوان مثال تجهیزات جراحی ، معرفهای آزمایشگاهی ، ابزارهای الکترونیکی ، بسته بندی استریل
داروها ، آنتی بیوتیک ها ، درمان سرطان ، داروهای ضد درد ، ضد احتقان ها ، آنتی هیستامین ها
تولید ف ، به عنوان مثال منیزیم ، نیکل ، تیتانیوم ، روی ، زیریوم
تفریح در فضای باز ، به عنوان مثال چادر ، کت ، کوله پشتی ، لباس ضد آب ، تخته های گشت و گذار ، گرفتن گلف
هیدروکلریک اسید ، که به اسید موریاتیک نیز معروف است ، محلول آبی گاز کلرید هیدروژن است. اسید هیدروکلریک در ایالات متحده و در درجه اول با چهار روش اساسی تولید می شود: کلرزنی مواد شیمیایی آلی. ترکیب هیدروژن و کلر؛ فرآیند تولید اسید سولفوریک و اسید و ، به عنوان یک محصول مشترک در تولید سیلیس. بیشتر اسید هیدروکلریک از کلر شدن مواد شیمیایی آلی با مقادیر بسیار کمتری نسبت به سایر مراحل تولید می شود.

اسید هیدروکلریک یک ماده شیمیایی مهم و پرکاربرد است. بیشترین کاربرد نهایی اسید هیدروکلریک ترشی از فولاد ، اسید شدن چاه روغن ، تولید مواد غذایی ، تولید کلرید کلسیم و فرآوری سنگ است.
هیدروکلریک اسید در عملیات ترشی برای فولادهای کربن ، آلیاژ و ضد زنگ استفاده می شود. ترشی فولادی فرآیندی است که با استفاده از آن اکسیدهای آهن و مقیاس از روی سطح فولاد با تبدیل اکسیدها به ترکیبات محلول خارج می شوند. ترشی برای محصولات فولادی که فرآوری بیشتری از قبیل تولید سیم ، پوشش ورق و نوار و محصولات آسیاب قلع مورد نیاز است مورد نیاز است. اسید هیدروکلریک در درجه اول برای عملیات ترشی مداوم مورد استفاده قرار می گیرد که در آن از فولاد نوار گرم نورد از طریق یک جریان متضاد محلول اسید عبور می کند.
علاوه بر ترشی از فولاد ، از اسید هیدروکلریک در اچ آلومینیوم ، پیشوند ف برای گالوانیزه و لحیم کاری و تمیز کردن فات استفاده می شود.
اسید هیدروکلریک هم برای از بین بردن رسوبات زنگ زدگی ، مقیاس و نامطلوب کربنات در چاههای نفت برای تشویق جریان نفت خام یا گاز به داخل چاه استفاده می شود. این استفاده "تحریک" نامیده می شود. اسیدی شدن به طور کلی در سازندهای کربنات یا سنگ آهک با تحریک انجام می شود. یک محلول اسیدی در سازند تزریق می شود ، که بخشی از سنگ را حل می کند و یک ساختار منافذ بزرگ را در سازند ایجاد می کند و باعث افزایش نفوذپذیری موثر آن و جریان روغن می شود.
صنایع غذایی در فرآوری انواع محصولات از اسید هیدروکلریک استفاده می کنند. عمده استفاده از اسید هیدروکلریک توسط صنایع غذایی برای تولید شربت ذرت مانند شربت ذرت با فروکتوز بالا (HFCS) است.
بخش عمده ای از اسید هیدروکلریک مصرف شده در صنعت HFCS برای بازسازی رزین های تبادل یونی که برای از بین بردن ناخالصی ها استفاده می شود ، استفاده می شود. از اسید هیدروکلریک نیز می توان برای اصلاح اسیدپاشی ذرت و تنظیم pH واسطه ها ، محصول نهایی و فاضلاب استفاده کرد. بیشترین کاربرد HFCS در تولید نوشابه است که 70-75٪ تقاضا را شامل می شود.
اسید هیدروکلریک نیز در سایر برنامه های غذایی از جمله تولید پروتئین گیاهی هیدرولیز شده و سس سویا استفاده می شود. این ماده در اسید کردن استخوان های خرد شده برای تولید ژلاتین و به عنوان یک اسید کننده کننده برای محصولاتی مانند سس ، آب میوه های گیاهی و مواد غذایی کنسرو استفاده می شود.
اسید هیدروکلریک در تولید شیرین کننده های مصنوعی مصرف می شود. این ماده در تولید لیزین ، کولین کلرید (که هر دو در درجه اول به عنوان مواد افزودنی خوراک دام استفاده می شوند) و اسید سیتریک مصرف می شود.
http://copper-sulfate.blog.ir/1399/01/14/%D8%A7%D8%B3%D8%AA%D9%81%D8%A7%D8%AF%D9%87-%D8%A7%D8%B2-%D8%B3%D9%88%D9%84%D9%81%D8%A7%D8%AA-%D8%A2%D9%87%D9%86-%D8%A8%D9%87-%D8%B9%D9%86%D9%88%D8%A7%D9%86-%D9%82%D8%A7%D8%AA%D9%84-%D8%AE%D8%B2%D9%87
خنثی کننده اسید هیدروکلریک با سنگ آهک (CaCO3)
کلسیم کلرید را تولید می کند. بیشترین کاربرد کلرید کلسیم ، خراشیدن بزرگراه با تولید وابسته به شرایط آب و هوایی است. سایر کاربردها شامل کنترل گرد و غبار ، فرآوری صنعتی ، بازیافت روغن ، تصفیه بتن و بالاستری تایرها است. کلرید کلسیم همچنین در محصولات نفتی مانند لجن حفاری و مایعات کار بیش از حد / تکمیل استفاده می شود.

اسید هیدروکلریک در بسیاری از عملیات معدن برای تصفیه سنگ ، استخراج ، جداسازی ، تصفیه و تصفیه آب مصرف می شود. از مقادیر قابل توجهی در بازیابی مولیبدن و طلا استفاده می شود. اسید هیدروکلریک برای تبدیل کنسانتره شلیلیت با درجه بالا (CaWO4) و تنگستات سدیم خام به اسید تنگستیز استفاده می شود که به نوبه خود می توان از آن برای تولید ف تنگستن و مواد شیمیایی استفاده کرد. اسید هیدروکلریک نیز در پردازش اورانیوم و زیریوم ، استخراج محلول از سنگ معدن بورات ، به عنوان یک تنظیم کننده pH در شناور کف سنگ معدن پتاس و در استخراج نادر از زمین از باستنیت استفاده می شود.
اسید هیدروکلریک آبی در انواع مختلفی از کاربردهای مختلف مورد استفاده قرار می گیرد. اینها شامل بازیابی فات نیمه قیمتی از کاتالیزورهای مورد استفاده ، استفاده به عنوان کاتالیزور در سنتز ، استفاده در بازسازی کاتالیزور ، کنترل pH ، بازسازی رزینهای تبادل یونی مورد استفاده در تصفیه فاضلاب و تاسیسات برقی ، خنثی سازی محصولات قلیایی یا مواد زاید و در اسیدی شدن آب نمک می باشد. برای استفاده در تولید کلر و سودا
اسید هیدروکلریک نیز در بسیاری از فرآیندهای تولید دیگر برای مواد شیمیایی آلی استفاده می شود. می توان از آن در تولید p-phenylenediamine ، رزین های پلی کربنات ، بیس فنول A ، رزین های پلی وینیل کلراید و اتانول (از اتیلن) استفاده کرد.
صنعت داروسازی از اسید هیدروکلریک به عنوان یک کاتالیزور در سنتز ، برای کنترل pH ، برای دیونیزه کردن آب و به عنوان یک ماده کاهش دهنده (به عنوان مثال ، در تولید اسید اسکوربیک و اسید پار آمینوبنزوئیک) استفاده می کند.
بسیاری از کاربردهای دیگر اسید هیدروکلریک شامل رنگ و رنگدانه ها می باشد. حذف لجن و مقیاس از تجهیزات صنعتی؛ ترمیم ، برنزه کردن و از بین رفتن پنهان های صنعت چرم؛ تولید لوسیون موجی دائمی؛ کربن سازی پشم؛ به عنوان دستیار سفید کننده و رنگرزی در صنعت نساجی استفاده کنید. و تصفیه ماسه و خاک رس.
http://www.ercoworldwide.com/index.php/products/hydrochloric-acid/
بوتیل گلیکول
آگوست 2020 | برگه اطلاعات | نسخه اول TI/E-CPI 1026e / صفحه 1 از 5
® = علامت تجاری ثبت شده BASF SE
توضیحات مایع با جوش بالا و فرار کم با بوی ملایم که به عنوان حلال استفاده می شود
و مواد اولیه برای سنتز. حلال عالی در آب
سیستم های پوشش (رنگ های مبتنی بر آب).
ماهیت شیمیایی اتیلن گلیکول مونو-n-بوتیل اتر، 2-بوتوکسی اتانول،
1-هیدروکسی-2-n-بوتوکسی اتان
فرمول مولکولی C6H14O2
جرم مولی 118.18 گرم بر مول
شماره CAS 111-76-2
شماره EC 203-905-0
مشخصات تحویل روش تست واحد ارزش ملک
بوتیل گلیکول 99.0 دقیقه % GC-Method BASF
آب حداکثر 0.1 ٪ DIN 51777، قسمت 1
مقدار رنگ Pt/Co
(هازن) حداکثر 10 - DIN EN ISO 6271
خواص مایع بی رنگ، خنثی، کمی مرطوب، متحرک با بوی ملایم. را
این محصول با آب و حلال های آلی رایج در تمام نسبت ها قابل اختلاط است
در دمای اتاق.
بوتیل گلیکول واکنش های معمول یک الکل را نشان می دهد، مانند استریفیکاسیون،
اتریفیکاسیون، اکسیداسیون و تشکیل استات ها و الکلات ها. مثل خیلی ها
اترها، در حضور اکسیژن اتمسفر پراکسید تشکیل می دهد.
TI/E-CPI 1026e اوت 2020 صفحه 2 از 5 بوتیل گلیکول
داده های فیزیکی داده های فیزیکی زیر در آزمایشگاه های BASF SE اندازه گیری شد.
آنها هیچ ضمانت اام آور قانونی املاک را برای ما نشان نمی دهند
محصول فروش
روش آزمون ارزش وضعیت ملک
محدوده جوش در 1013 hPa;
95 جلد-%;
2 تا 97 میلی لیتر
168 - 172 درجه سانتیگراد DIN 51751
چگالی در 20 درجه سانتیگراد 0.8995 - 0.9020
g/cm3 DIN 51757
ضریب شکست nD20 1.4190 - 1.4200 DIN 51423
نقطه انجماد 70.4 درجه سانتیگراد -
نرخ تبخیر اتر = 1 160 DIN 53170
آنتالپی از
احتراق (Hc) در 20 درجه سانتی گراد 32 397 کیلوژول بر کیلوگرم -
آنتالپی از
تبخیر ( Hv) در نقطه جوش 368 کیلوژول بر کیلوگرم -
گشتاور دوقطبی () 2.08 D
پارامترهای حلالیت هانسن
d = 16.0 (MPa) 1/2
p = 5.1 (MPa) 1/2
h = 12.3 (MPa) 1/2
t = 20.8 (MPa) 1/2
TI/E-CPI 1026e اوت 2020 صفحه 3 از 6 بوتیل گلیکول
T [C] فشار بخار
P [hPa]
تراکم
r [g/cm3
]
ویسکوزیته
[mPa·s]
-60 0.9655 255.1
-40 0.9499 46.2
-20 0.9339 14.4
0 0.17 0.9176 6.2
20 0.89 0.9006 3.3
30 0.8924 2.5
40 3.7 0.8839 2.0
50 7.1 0.8752 1.6
60 12.5 0.8665 1.3
80 36.3 0.8488 0.9
100 90.6 0.8308 0.7
120 201 0.8124 0.5
140 404 0.7936 0.4
160 744 0.7746 0.3
171.2 1013
T [C] گرمای ویژه
Cp [kJ/(kg·K)]
کشش سطحی
[mN/m]
0 2.13
20 2.26 27.8
30 2.33 27.0
40 2.40 26.2
50 2.47 25.4
60 2.55
80 2.71
100 2.89
120 3.08
منبع
https://bismoot.com/blog/%d8%a8%d9%88%d8%aa%db%8c%d9%84-%da%af%d9%84%db%8c%da%a9%d9%88%d9%84/
درباره این سایت